Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 991 questões
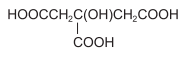
Ácido cítrico
A partir dessas informações, é correto afirmar:
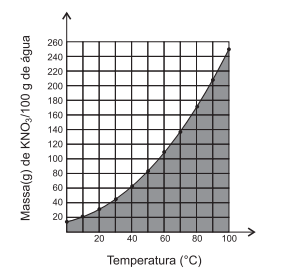
O gráfico representa a variação do coeficiente de solubilidade de nitrato de potássio com a temperatura.
Uma análise desse gráfico permite afirmar:
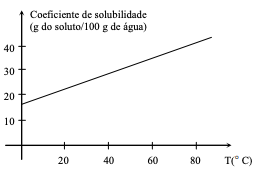
A partir dos dados constantes do gráfico, pode-se afirmar:
Na preparação de uma solução diluída, com base em uma mais concentrada, retira-se um volume de solução concentrada de hidróxido de sódio (NaOH) 1 mol/L para se preparar 500 mL de uma solução diluída de 0,2 mol/L.
Se C1V1=C2V2, o volume inicial de solução de NaOH 1 mol/L retirado para se obter a solução diluída corresponderá a:
I - Colocando-se, em água, uma quantidade de sal superior à sua solubilidade, obtém-se uma solução saturada em equilíbrio com a porção do sal não dissolvida, formando um sistema homogêneo. II - Detecta-se experimentalmente que as concentrações dos íons H3O+ e OH− para as soluções salinas podem ou não ser alteradas em relação às da água pura e que soluções de cloreto de amônio (NH4Cl) são alteradas, com a concentração de H3O+ aumentando e de OH− diminuindo, assim, tem-se que soluções de cloreto de amônio são ácidas. III - Sais que formam soluções básicas têm um ânion capaz de reagir com a água, alterando, para maior, a concentração do íon OH− . IV - A reação de hidrólise de qualquer sal ocorre sempre com a formação de um ácido ou uma base fraca.
Estão corretas as afirmativas
Um estudante de química prepara 1 litro de cada solução aquosa abaixo.
Solução I: Cloreto de sódio (NaCl): 0,26 molar
Solução II: Nitrato de cálcio [Ca(NO3)2]: 0,15 molar
Solução III: Sulfato de alumínio [Al2(SO4)3]: 0,11 molar
A relação entre as massas dos cátions presentes nas soluções é bem
próxima de:
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
A tartrazina é uma substância muito utilizada para colorir alimentos. No entanto, estudos apresentam a ocorrência de alergias principalmente em pessoas sensíveis ao ácido acetilsalicílico, porém sem resultados conclusivos. Para efeito da utilização da tartrazina como aditivo alimentar, a Agência Nacional de Vigilância Sanitária (ANVISA) define seu limite máximo de 30 mg por 100 gramas de amostra e um IDA (Ingestão Diária Aceitável) de 7,5 mg/Kg de peso corpóreo para tartrazina.
I - 2 NaHCO3
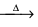 X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y
X + CO2 + H2O
II - X + Ca(OH)2 → 2 NaOH + Y Sobre esse processo, assinale a afirmativa correta.
LIMA, A.C.S.; AFONSO, C., A Química dos Refrigerantes. Química Nova na Escola, 31(3), 2009. (adaptado)
As duas palavras que completam o texto são, respectivamente:
I - H2SO4
II - HCl
III - NaOH
IV - CaCO3
Para diminuir a acidez de um solo, pode-se utilizar um NPK que possua uma maior quantidade de
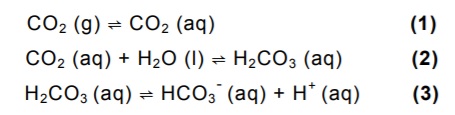
As etapas (1) e (3), mostradas na questão anterior, representam, respectivamente, processos de:
A concentração de CO2 na atmosfera vem aumentando nos últimos anos. Segundo os cientistas, o aumento da quantidade desse gás que é dissolvida no oceano pode prejudicar particularmente os corais e as espécies que têm conchas duras.
O equilíbrio do CO2 em solução aquosa pode ser representado pelas seguintes etapas:
CO2 (g) ⇌ CO2 (aq) (1)
CO2 (aq) + H2O (l) ⇌ H2CO3 (aq) (2)
H2CO3 (aq) ⇌ HCO3 - (aq) + H+ (aq) (3)
A dissolução do CO2 no oceano provoca
Um estudante observou que uma limonada fica mais doce quando o açúcar é dissolvido na água antes de se adicionar o gelo. Isso acontece porque, com a diminuição da

A mistura de dihidrogeno-pirofosfato de sódio com hidrogenocarbonato de sódio, de acordo com a equação química, é utilizada como fermento químico na produção industrial de bolos, pães e biscoitos. Essa é uma forma rápida de fazer expandir, durante o aquecimento, a massa para o preparo desses alimentos, em relação à utilizada com fermento biológico.
Considerando-se essas informações, é correto afirmar:
Determinada espécie de peixes, a exemplo dos salmões, é capaz de perceber a presença na água de 2-fenil-etanol, representado pela fórmula química, em concentrações muito pequenas, como a de 4,0g em 1,0.1014L.
A análise dessas informações permite afirmar: