Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 971 questões
Considere as informações:
• No estado de Sergipe, encontram-se as maiores reservas brasileiras de minerais de potássio, constituídas principalmente por silvinita, composta pela associação dos minerais halita (NaCl) e silvita (KCl). O teor médio de íons potássio na silvinita é cerca de 8% em massa.
• Na água do mar, a concentração média de íons potássio é cerca de 0,4 g/L.
O volume de água do mar que contém a mesma massa de íons potássio existente em cada tonelada de silvinita é
O quadro apresenta informações sobre quatro substâncias químicas, todas brancas, em pó.
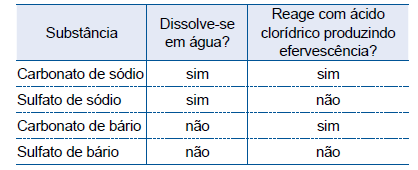
Um professor forneceu aos seus alunos uma cópia desse quadro, amostras de duas dessas substâncias, sem qualquer identificação, e solicitou que os estudantes as identificassem.
Os alunos notaram que uma das amostras se dissolveu em
água e outra não e que apenas a substância insolúvel em
água reagiu com ácido clorídrico, produzindo efervescência.
Então, eles concluíram que as amostras recebidas eram de
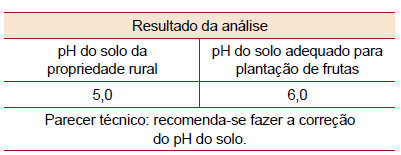
Para que o agricultor possa fazer a correção do pH do solo de forma adequada para a sua produção, ele deverá adicionar ao solo
2FeS2 + 7O2 + 2H2O → 2FeSO4 + 2H2SO4
Em uma amostra de água retirada de um rio, foi encontrada uma concentração de FeSO4 igual a 0,02 mol/L. Nesse rio, a massa de FeS2 dissolvida por litro de água era igual a
Com relação às estruturas e às propriedades dos óxidos de elementos químicos do terceiro período, é correto afirmar:
Considerando-se as informações do texto associadas aos conhecimentos sobre soluções aquosas, é correto afirmar:
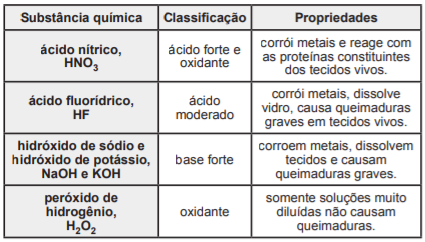
As substâncias químicas corrosivas – como os ácidos e as bases fortes, os agentes oxidantes e os desidratantes –, a exemplo das mencionadas na tabela, devem ser utilizadas com cautela, porque o contato com elas, além da corrosão de materiais metálicos, causa a deterioração de tecidos presentes nos seres vivos.
MANAHAN, Stanley E. Química ambiental, e. 9. Porto Alegre: Bookman, 2013, p. 681. Adaptado.
Considerando-se essas informações e as propriedades das substâncias químicas, é correto afirmar:
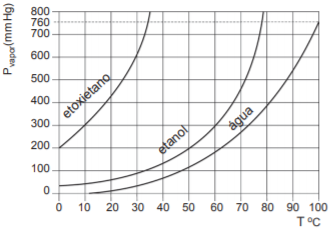
Considerando-se essa informação associada às propriedades físicas dos líquidos puros, é correto afirmar:
1) Os estados de oxidação do enxofre no SO2 e no SO3 são ambos iguais a +4. 2) O cloreto de sódio é considerado um sal neutro. 3) O número de oxidação do nitrogênio no KNO2 é igual a +3.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: massa atômica do ferro = 56 g.mol-1.
Dados: massa molecular da glicose = 180 g.mol-1 e constante ebulioscópica (Ke) da água = 0,52°C.molal-1
Dados: Massas molares em g.mol−1: Fe = 56; S = 32; O = 16.
Leia o texto para responder à questão.
Na Estação de Tratamento de Água (ETA), diferentes substâncias químicas são adicionadas à água nos diversos tanques por onde ela passa. No tanque de floculação, por exemplo, a adição de certas substâncias químicas estimula a formação de um composto gelatinoso, o hidróxido de alumínio, que provoca a aglutinação das partículas de sujeira. Essas partículas aderem ao composto gelatinoso, formando flóculos sólidos de tamanho maior, que são facilmente sedimentáveis.

(www.sobiologia.com.br. Adaptado.)
A substância química gelatinosa formada no tanque de floculação apresenta caráter __________ e valor de pH ____________ 7 a 25 ºC. Ao combinar-se com um ácido, essa substância forma ____________e _____________ , ocorrendo uma reação de _____________.
Completam as lacunas do texto, respectivamente,
Para essas espécies químicas, constata-se que

Frasco Identificação 1 Solução de HCl 0,1 mol/L 2 Solução de Glicose 0,5 mol/L 3 Solução de MgCl2 0,1 mol/L 4 Solução de KCl 0,2 mol/L 5 Solução de CaCl2 0,2 mol/L
Analisando a descrição dos frascos, o aluno chegou à conclusão de que a ordem crescente de temperatura de congelamento das soluções é:
