Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 991 questões


Em países de inverno rigoroso, lagos e rios congelam-se na superfície e a água de máxima densidade encontra-se no fundo a 4 ºC. Esse fato é de fundamental importância para a preservação da vida aquática. Outro fenômeno comum de lugares frios é a formação de finas camadas de gelo nas ruas e nas estradas. Para abrandar os danos causados por esse gelo depositado, os moradores costumam jogar sal (NaCl) sobre o gelo. Considerando as afirmações acima e os dados de que a constante molal de diminuição do ponto de congelamento da água (Kc) é 1,9 e que 0 ºC e 100 ºC correspondem a 32 ºF e 212 ºF, respectivamente, assinale o que for correto.


Em países de inverno rigoroso, lagos e rios congelam-se na superfície e a água de máxima densidade encontra-se no fundo a 4 ºC. Esse fato é de fundamental importância para a preservação da vida aquática. Outro fenômeno comum de lugares frios é a formação de finas camadas de gelo nas ruas e nas estradas. Para abrandar os danos causados por esse gelo depositado, os moradores costumam jogar sal (NaCl) sobre o gelo. Considerando as afirmações acima e os dados de que a constante molal de diminuição do ponto de congelamento da água (Kc) é 1,9 e que 0 ºC e 100 ºC correspondem a 32 ºF e 212 ºF, respectivamente, assinale o que for correto.


Em países de inverno rigoroso, lagos e rios congelam-se na superfície e a água de máxima densidade encontra-se no fundo a 4 ºC. Esse fato é de fundamental importância para a preservação da vida aquática. Outro fenômeno comum de lugares frios é a formação de finas camadas de gelo nas ruas e nas estradas. Para abrandar os danos causados por esse gelo depositado, os moradores costumam jogar sal (NaCl) sobre o gelo. Considerando as afirmações acima e os dados de que a constante molal de diminuição do ponto de congelamento da água (Kc) é 1,9 e que 0 ºC e 100 ºC correspondem a 32 ºF e 212 ºF, respectivamente, assinale o que for correto.

Alimentos estão sendo quimicamente adulterados por alguns fabricantes. Isso tem ocorrido a fim de baratear os custos de fabricação e de lucrar com as vendas ou por falhas no processo de envasamento do produto. Exemplo disso é o caso de um achocolatado que foi colocado no mercado com pH de 13,3 (básico), equivalente ao de produtos de limpeza, como soda cáustica (NaOH) e água sanitária (hipoclorito de sódio, NaClOaq), sendo que o pH do achocolatado deveria estar próximo de 7 (neutro). A partir dessas considerações, assinale o que for correto.

Alimentos estão sendo quimicamente adulterados por alguns fabricantes. Isso tem ocorrido a fim de baratear os custos de fabricação e de lucrar com as vendas ou por falhas no processo de envasamento do produto. Exemplo disso é o caso de um achocolatado que foi colocado no mercado com pH de 13,3 (básico), equivalente ao de produtos de limpeza, como soda cáustica (NaOH) e água sanitária (hipoclorito de sódio, NaClOaq), sendo que o pH do achocolatado deveria estar próximo de 7 (neutro). A partir dessas considerações, assinale o que for correto.

Alimentos estão sendo quimicamente adulterados por alguns fabricantes. Isso tem ocorrido a fim de baratear os custos de fabricação e de lucrar com as vendas ou por falhas no processo de envasamento do produto. Exemplo disso é o caso de um achocolatado que foi colocado no mercado com pH de 13,3 (básico), equivalente ao de produtos de limpeza, como soda cáustica (NaOH) e água sanitária (hipoclorito de sódio, NaClOaq), sendo que o pH do achocolatado deveria estar próximo de 7 (neutro). A partir dessas considerações, assinale o que for correto.

Alimentos estão sendo quimicamente adulterados por alguns fabricantes. Isso tem ocorrido a fim de baratear os custos de fabricação e de lucrar com as vendas ou por falhas no processo de envasamento do produto. Exemplo disso é o caso de um achocolatado que foi colocado no mercado com pH de 13,3 (básico), equivalente ao de produtos de limpeza, como soda cáustica (NaOH) e água sanitária (hipoclorito de sódio, NaClOaq), sendo que o pH do achocolatado deveria estar próximo de 7 (neutro). A partir dessas considerações, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

O paracetamol (C8H9NO2) é o princípio ativo do medicamento Tylenol®, utilizado como analgésico e antitérmico. Pode ser comercializado na forma de solução oral (200 mg.mL–1) ou comprimido (500 mg ou 750 mg). É um dos analgésicos mais utilizados, porém é altamente perigoso para o fígado, devido ao seu alto potencial hepatotóxico, não devendo ser utilizados mais do que 8 comprimidos de 500 mg ao dia. Com base nessas informações, assinale o que for correto.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Assumindo que a concentração de SO2 em uma solução é de 1 x 10-3 mols por litro, uma alíquota de 200 ml dessa solução terá aproximadamente 6,4 mg de dióxido de enxofre.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Sabendo-se que o soro fisiológico é uma solução isotônica em relação aos líquidos corporais e que o mesmo contém 0,6% (massa/volume) de NaCl em água, sua concentração em mol/ℓ será aproximadamente 0,1.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
São necessários 42 g de fluoreto de sódio para fluoretar 38.000 litros de água, de tal modo que a concentração de íons fluoreto seja 0,5 ppm (partes por milhão).
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Uma bebida alcoólica que possui 10% em massa de etanol e densidade igual a 0,97 g/mℓ terá uma concentração aproximada de 2,1 mol/ℓ.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Ácidos possuem sabor adstringente, enquanto bases possuem sabor azedo.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
O Al(OH)3 é uma tribase de Arrhenius.
COM MASSAS ATÔMICAS REFERIDAS AO ISÓTOPO 12 DO CARBONO

*OS VALORES DAS MASSAS ATÔMICAS DOS ELEMENTOS FORAM ARREDONDADOS PARA FACILITAR OS CÁLCULOS. ESTA TABELA PERIÓDICA É EXCLUSIVA PARA ESTE VESTIBULAR E NÃO DEVE SER UTILIZADA PARA OUTRAS FINALIDADES.
Bases são mais adequadas do que os ácidos, para remoção de gorduras em geral.
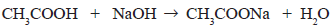
- até 200 mg/dL, DESEJÁVEL; - de 201 a 239 mg/dL, ACEITÁVEL; - a partir de 240 mg/dL, AUMENTADO.
Na análise laboratorial de uma amostra de sangue, foi determinado 2,1 g L-1 de colesterol, cuja fórmula molecular é C27H46O. Quantos mols de colesterol estão presentes aproximadamente e como está o nível de colesterol nessa amostra em relação aos valores tabelados acima?
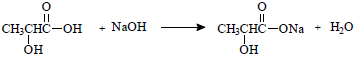
Admitindo-se a concentração de 1,8 g.L-1 de ácido láctico em um lote de 200 L de leite longa vida, qual o volume aproximado, em litros, de solução de NaOH 0,5 mol.L-1, para neutralizar completamente todo o ácido láctico contido nesse lote?