Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 980 questões
A importância da água. Toda Matéria. Disponível em:<https://www.todamateria.com.br/a-importancia-da-agua/>. Acesso em: 07 set. 2017. Adaptado.
A respeito da substância água, marque a alternativa INCORRETA.
Determinado óxido de urânio é a base para geração de energia através de reatores nucleares e sua amostra pura é composta por 24,64 g de Urânio e 3,36 g de Oxigênio. Considerando-se essas informações, a fórmula mínima desse composto deve ser
Dado: MA(O) = 16 g/mol
MA(U) = 238 g/mol
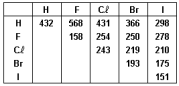
Analise as afirmações seguintes.
I. Dentre os compostos HX, o HF é o ácido mais fraco e a sua ligação H-X é a mais forte. II. A distância de ligação entre os átomos nas moléculas X2 é maior no I2, já que a sua energia de ligação é a mais fraca. III. A molécula com maior momento dipolar é o HI.
Está correto o contido em
Sobre esses dados é correto afirmar que
I. 10g de NaCl em 100g de água. II. 10g de NaCl em 100ml de água. III. 20g de NaCl em 180g de água. IV. 10 mols de NaCl em 90 mols de água.
Destas soluções, tem concentração 10% em massa de cloreto de sódio:
Analise as afirmativas.
I - A elevação do pH de uma piscina favorece a dissolução dos floculantes presentes na água.
II - O pH de um suco de tomate, em média, deverá ser igual a 4,2 – aproximadamente 1000 vezes mais ácido que a água de uma piscina em boas condições.
III - No tratamento de uma piscina é comum a utilização de barrilha (Na2CO3 – carbonato de sódio) para a elevação do pH, pois produz uma solução de caráter alcalino.
IV - No tratamento de microrganismos em piscinas, é comum a utilização de sais de hipoclorito, que fornecem à água o íon Cl-(aq) .
São verdadeiras, apenas

A daminozida, também conhecida como Alar, é um regulador do crescimento de plantas, usado na pulverização de frutas, como
maçãs, para tornar mais fácil a colheita e evitar a queda das frutas antes do amadurecimento. O Alar garante a cor vermelha
e a firmeza da fruta para embalagem. A Agência de Proteção Ambiental dos Estados Unidos proibiu, em 1989, o uso da substância
química para consumo humano, em razão de apresentar alto risco carcinogênico. O produto da degradação da daminozida, a
dimetil-hidrazina assimétrica, UDMH, usada em combustíveis para foguetes espaciais e mísseis, é também carcinogênico.
Normalmente, os riscos e a quantidade de aditivo de alimentos consumidos na ingestão de maçãs não são informados pelos
produtores e distribuidores de frutas.
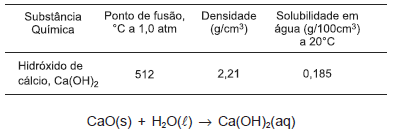
O hidróxido de cálcio, conhecido como cal hidratada ou extinta, é um sólido branco pouco solúvel em água, utilizado na preparação de argamassa e na pintura de paredes. No tratamento de água e de esgotos, participa como regulador de pH e floculante.
Considerando-se as informações da tabela, da equação química e do texto, é correto afirmar:
As lacunas do texto devem ser preenchidas por:
Com relação aos conceitos sobre ácidos e bases, três afirmações foram feitas:
1) Na reação de dissociação do HCl em água: HCl(g) + H2O(l)
 H3O+(aq) + Cl−
(aq)
a água é considerada uma base de Arrhenius. 2) Na reação da amônia com o HCl:
NH3(aq) + HCl(aq)
H3O+(aq) + Cl−
(aq)
a água é considerada uma base de Arrhenius. 2) Na reação da amônia com o HCl:
NH3(aq) + HCl(aq)  NH4+(aq) + Cl−
(aq)
a amônia é considerada uma base de BronstedLowry.
3) Na reação do BF3 + F−
: BF3 + F− → BF4
− o BF3
é considerado um ácido de Lewis.
NH4+(aq) + Cl−
(aq)
a amônia é considerada uma base de BronstedLowry.
3) Na reação do BF3 + F−
: BF3 + F− → BF4
− o BF3
é considerado um ácido de Lewis.
Está(ão) correta(s) a(s) afirmativa(s):
Dados: Massas molares em g . mol−1 : H = 1; C = 12; O = 16; S = 32; Na = 23; Au = 197.
As concentrações de Myocrisin nas injeções intramusculares e no soro sanguíneo, em mol.L −1, são, respectivamente:
O cloreto de amônio, NH4Cl, é uma substância química sólida de cor branca, utilizada pelos egípcios, na antiguidade, como adubo. O fertilizante era obtido a partir de esterco de camelos.
Considerando-se essas informações, é correto afirmar: