Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 991 questões
As palavras que completam corretamente as lacunas são:

Tomar um copo de suco de uva por dia pode trazer mais benefícios para saúde do que você imagina. Isso porque a fruta contém bioflavonóides, taninos e o resveratrol, substâncias que agem como proteção no organismo, reduzindo os riscos de doenças como colesterol, infartos e câncer, além de contribuir com a redução de tumores no pulmão, intestino e cólon.
A bebida também age como antioxidante, favorecendo as funções hepáticas do fígado, além de ser um valioso estimulante digestivo. O suco de uva é um forte aliado para quem se preocupa com a saúde. Confira os benefícios do suco: acelera o metabolismo, fortalece o sistema imunológico e retarda o envelhecimento.
Uma das formas de se conservar o suco de uva é através da adição do ácido sulfuroso. A reação de decomposição do ácido sulfuroso em meio aquoso, presente no suco de uva, à temperatura e pressão ambientes:
Muitos produtos químicos são comumente usados em nosso dia-dia por várias situações, algumas são mitos e outras são verdades:
O ácidoclorídrico (Composto X) vem da dissolução do gás cloreto de hidrogênio em água. Ele é usado em laboratório, em indústrias, na forma impura em produtos de limpeza de pisos com o nome de ácido muriático e é um dos componentes do suco gástrico do estômago.
O bicarbonato de sódio (Composto Y) é usado como antiácido, para tratar a acidez do estômago porque ele tem o poder de neutralizar os excessos do ácido clorídrico do suco gástrico, devido ao fato de ser uma substância ligeiramente alcalina(ph=9). Em algumas formulações farmacêuticas, é misturado aos ácidos cítrico e tartárico, ambos sólidos.Além do uso farmacêutico e culinário, o bicarbonato de sódio também é um ótimo auxiliar na limpeza de ambientes e de roupas. O produto tem ação anti-mancha, anti-mofo e elimina o mau cheiro.
O composto químico Hipoclorito de sódio, (Composto Z) é usado como desinfetante e como agente alvejante. Recebe o nome popular de água sanitária e é produzido pela reação de cloro com hidróxido de sódio
O vinagre (que contém ácido acético) (Composto W) pode ser usado para limpar rabiscos nas paredes, marcas de sapatos ou de móveis. O vinagre branco é uma solução rápida para remover essas manchas sobre a pintura. É preciso fazer uma mistura com a mesma quantidade de vinagre e água morna, um litro de água para quatro colheres de vinagre.
As fórmulas químicas dos compostos X, Y, Z, W são respectivamente:
O texto abaixo está presente na legislação que institui o Código de Trânsito Brasileiro- CTB.
“[...]Conduzir veículo automotor, na via pública, estando com concentração de álcool por litro de sangue igual ou superior a 6 (seis) decigramas, ou sob a influência de qualquer outra substância psicoativa que determine dependência: Penas - detenção, de seis meses a três anos, multa e suspensão ou proibição de se obter a permissão ou a habilitação para dirigir veículo automotor. [...]”
Um condutor automotivo parado em uma operação policial, após ser submetido a análises técnicas, apresentou uma concentração de 21 decigramas de álcool por litro de sangue.
Com base no texto acima e nos conceitos químicos, analise as afirmações a seguir.
I- A concentração de álcool no sangue desse condutor é de 2,1μg/μL.
II- O condutor deverá ser penalizado segundo a legislação do CTB.
III- Caso o condutor possua em seu organismo um volume de sangue igual a 5,0 L, a quantidade de álcool presente em seu corpo é de 10,5 g.
IV - A combustão completa do etanol geral CO e água.
Assinale a alternativa correta.
O ácido oxálico (H2C2O4) está presente em caules e folhas de vegetais como o espinafre e a beterraba. Uma maneira de quantificar a concentração de ácido oxálico nos vegetais é através da titulação com hidróxido de sódio (NaOH). Para realizar uma titulação, pretende-se escolher um indicador adequado para o ponto de equivalência mostrado no gráfico. O quadro apresenta os indicadores disponíveis no laboratório.

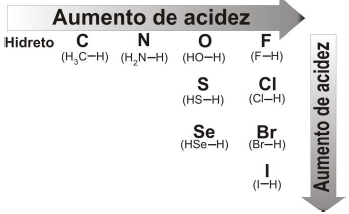
Analise os dados apresentados na figura e assinale a alternativa CORRETA.
As reações envolvidas no processo são:
C8O2H7CO2H (aq) + NaOH (aq) → C8O2H7CO2Na (aq) + H2O (l) H2SO4 (aq) + 2 NaOH (aq) → Na2SO4 (aq) + 2 H2O (l)
Dada a massa molar do ácido acetilsalicílico = 180 g/mol.
O teor (percentual em massa) de ácido acetilsalicílico encontrado pelo estudante no comprimido de aspirina foi de
Atualmente o cloreto de hidrogênio pode ser obtido por reação direta dos gases hidrogênio molecular e cloro molecular em uma câmara de combustão especial. O gás cloreto de hidrogênio é muito solúvel em água, e soluções aquosas de HCl são comercializadas como ácido clorídrico. A decapagem do aço é uma atividade em que se emprega o ácido clorídrico. Trata-se da remoção de óxidos, como, por exemplo, o óxido de ferro(III), da superfície do aço após o processo de laminação das chapas de aço. A decapagem ocorre pela ação de uma solução ácida diluída entre as temperaturas de 80ºC e 90ºC.
Considerando as informações do texto, é correto afirmar que
“Os íons de metais alcalinos têm importantes funções no nosso organismo, tais como influenciar em contrações musculares e pressão arterial, manter a pressão osmótica dentro das células e influenciar a condução dos impulsos nervosos. A diferença nas concentrações totais de íon de metais alcalinos dentro e fora da célula produz um potencial elétrico pela membrana celular, responsável, por exemplo, pela geração de sinais elétricos rítmicos no coração. As concentrações de Na+ e K+ nas células sanguíneas vermelhas são de 0,253 g.L−1 e de 3,588 g.L−1, respectivamente”.
Rayner-Canham, G.; Overton, T.
Química Inorgânica Descritiva. LTC.
As concentrações aproximadas desses íons, em
mol L−1, são respectivamente
Os óxidos emitidos nesse processo e transformados na atmosfera são depositados no solo, ocasionando a sua
Leia o texto e analise as informações sobre teor de cafeína nas amostras apresentadas a seguir.
Bebidas e alimentos contendo cafeína (C8 H10N4 O2 ) são apreciados no mundo todo, o que motiva uma extensa produção agrícola. Apesar de sua popularidade, a cafeína é considerada uma substância tóxica, podendo levar à morte se for consumida em uma dose de 10 g ou superior. No Rio Grande do Sul, o mate e o café são muito populares, mas qual deles tem a maior quantidade de cafeína? A tabela abaixo mostra a quantidade de cafeína encontrada em algumas amostras.
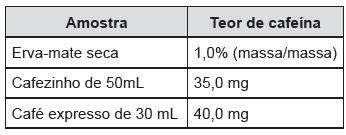
Em relação aos dados apresentados, assinale a
alternativa correta
INSTRUÇÃO: Para responder à questão, analise a representação do glifosato a seguir.
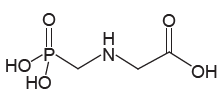
O uso de agrotóxicos é objeto de preocupações, pois o contato com doses elevadas no momento da aplicação tem causado sérios problemas de saúde a trabalhadores rurais. Esse problema se agrava quando os agricultores aplicam doses maiores do que as recomendadas, em uma tentativa de controlar pragas resistentes. O glifosato, por exemplo, no uso agrícola comum, é adquirido como uma solução com a concentração de 360 gramas por litro, sendo aplicados cinco litros por hectare (um hectare equivale a 10000 m²).
Sobre esse assunto, fazem-se as seguintes afirmativas.
I. Em uma aplicação de glifosato, cada hectare de lavoura recebe mais de 1,0×1023 moléculas desse herbicida.
II. Em uma molécula de glifosato há mais átomos de hidrogênio do que de oxigênio.
III. A concentração de glifosato na solução é de aproximadamente 2,1 mol/L.
Está/Estão correta(s) a(s) afirmativa(s)
Os chamados “remédios homeopáticos” são produzidos seguindo a farmacotécnica homeopática, que se baseia em diluições sequenciais de determinados compostos naturais. A dosagem utilizada desses produtos é da ordem de poucos mL. Uma das técnicas de diluição homeopática é chamada de diluição centesimal (CH), ou seja, uma parte da solução é diluída em 99 partes de solvente e a solução resultante é homogeneizada (ver esquema). Alguns desses produtos homeopáticos são produzidos com até 200 diluições centesimais sequenciais(200CH).
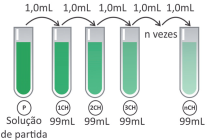
Considerando uma solução de partida de 100 mL com concentração 1 mol/L de princípio ativo, a partir de qual diluição centesimal a solução passa a não ter, em média, nem mesmo uma molécula do princípio ativo?
Note e adote:
Número de Avogadro = 6×1023.
No preparo de certas massas culinárias, como pães, é comum adicionar-se um fermento que, dependendo da receita, pode ser o químico, composto principalmente por hidrogenocarbonato de sódio (NaHCO3), ou o fermento biológico, formado por leveduras. Os fermentos adicionados, sob certas condições, são responsáveis pela produção de dióxido de carbono, o que auxilia a massa a crescer. Para explicar a produção de dióxido de carbono, as seguintes afirmações foram feitas.
I. Tanto o fermento químico quanto o biológico reagem com os carboidratos presentes na massa culinária, sendo o dióxido de carbono um dos produtos dessa reação.
II. O hidrogenocarbonato de sódio, presente no fermento químico, pode se decompor com o aquecimento, ocorrendo a formação de carbonato de sódio (Na2CO3), água e dióxido de carbono.
III. As leveduras, que formam o fermento biológico, metabolizam os carboidratos presentes na massa culinária, produzindo, entre outras substâncias, o dióxido de carbono.
IV. Para que ambos os fermentos produzam dióxido de carbono, é necessário que a massa culinária seja aquecida a temperaturas altas (cerca de 200 °C), alcançadas nos fornos domésticos e industriais.
Dessas afirmações, as que explicam corretamente a produção de dióxido de carbono pela adição de fermento à massa culinária são, apenas,
Em ambientes naturais e na presença de água e gás oxigênio, a pirita, um mineral composto principalmente por dissulfeto de ferro (FeS2), sofre processos de intemperismo, o que envolve transformações químicas que acontecem ao longo do tempo.
Um desses processos pode ser descrito pelas transformações sucessivas, representadas pelas seguintes equações químicas:
2FeS2(s) + 7 O2(g) + 2H2O(ℓ) → 2 Fe2+(aq) + 4SO2-4(aq) + 4H+(aq)
2Fe2+(aq) + ½ O2(g) + 2H+(aq) → 2Fe3+(aq) + H2O(ℓ)
2 Fe3+(aq) + 6 H2O(ℓ) → 2 Fe(OH)3 (s) + 6 H+(aq)
Considerando a equação química que representa a transformação global desse processo, as lacunas da frase “No intemperismo sofrido pela pirita, a razão entre as quantidades de matéria do FeS2 (s) e do O2 (g) é __________, e, durante o processo, o pH do solo __________” podem ser corretamente preenchidas por