Questões de Vestibular
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 996 questões
Os combustíveis para veículos automotores de passeio mais comercializados no Brasil são o álcool etílico hidratado (pureza de 96%)eagasolina comum, contendo 27% de álcool etílico anidro. Em grandes centros, utiliza-se como alternativa o GNV (gás natural veicular) constituído por hidrocarbonetos leves (contém, no mínimo, 87% de metano e outros hidrocarbonetos leves). Nos motores a explosão, a potência pode variar em função da composição química e das propriedades físico-químicas dos combustíveis. Assim, a adoção de um determinado combustível não adulterado em detrimento de outro pode alterar o desempenho do motor e, também, influenciar o nível de emissão de poluentes na atmosfera.
Em relação às propriedades físico-químicas e à composição química desses combustíveis comercializados no Brasil, assinale a alternativa correta.
I. HCl + NaOH → X + H2O II. H2CO3 + KOH → Y + H2O III. Z + NH4OH → NH4ClO + H2O
A nomenclatura correta para as substâncias X, Y e Z, respectivamente, é:
0,5 mol de cloreto de magnésio foi dissolvido em água suficiente para formar 1L de solução. 10 mL dessa solução foram transferidos para um balão volumétrico de 100mL, o qual foi completado até a marca de aferição com água destilada. Após agitar a amostra diluída, 5mL dessa solução foram transferidos para outro balão volumétrico de 100mL, o qual também foi completado até a marca de aferição com água destilada.
Qual é a concentração de íons cloro na solução final?
A seguir estão listadas algumas características de uma classe de compostos:
• Apresentam caráter covalente;
• São compostos binários;
• Reagem com água produzindo ácidos;
• Reagem com base produzindo sal e água.
Qual é a classe de compostos representados por essas características?
Porção de 250 ml (1 copo) valor energético 106 kcal (445 kJ) carboidratos 26 g sódio 20 mg
Sabendo que o valor energético do açúcar refinado comum (sacarose, C12H22O11) é aproximadamente 400 kcal/100 g, conclui-se que, em termos nutricionais, a ingestão de 1 copo do refrigerante em questão equivale, energeticamente, à ingestão de 250 mL de uma solução aquosa que contenha dissolvida uma massa de açúcar, em gramas, próxima de

O dióxido de carbono é produto da respiração, da queima de combustíveis e é responsável pelo efeito estufa. Em condições ambiente, apresenta-se como gás, mas pode ser solidificado por resfriamento, sendo conhecido nesse caso como gelo seco.
Acerca da estrutura de Lewis do dióxido de carbono, considere as afirmativas a seguir (se houver mais de uma estrutura de Lewis possível, considere a que apresenta mais baixa carga formal dos átomos, isto é, a mais estável segundo o modelo de Lewis):
1. Entre o átomo de carbono e os dois oxigênios há duplas ligações.
2. O NOX de cada átomo de oxigênio é igual a -2.
3. O NOX do carbono é igual a zero.
4. O átomo de carbono não possui elétrons desemparelhados.
Assinale a alternativa correta.
Após o preparo de uma solução 5x10-2 mol/L de NaNO2, pode-se afirmar que o pH é aproximadamente igual a: (Dados: Ka=5x10-4 para HNO2); Kw=1,0x10-14 a 25°C).
I) Ao adicionarmos um soluto em um solvente haverá diminuição do ponto de congelamento da solução se o soluto for insolúvel na fase sólida do solvente. II) A adição de um soluto não volátil a uma solução leva a diminuição do ponto de ebulição desta, pela maior atração entre as moléculas. III) Quando duas soluções de concentrações diferentes são separadas por uma membrana semi-permeável, a pressão osmótica faz com que o solvente passe da solução menos diluída para a mais diluída. IV) A relação quantitativa entre o abaixamento da pressão de vapor e a concentração de uma solução ideal é estabelecida pela lei de Raoult.
Estão CORRETAS as afirmativas:
Frente ao exposto, pode-se inferir que:
Ca(HCO3) 2(aq) -> Xs + CO2(g) + H2O
A letra X representa qual sal?
Em regiões industrializadas ou em grandes cidades, que possuem tráfego intenso, ocorre o fenômeno conhecido como smog fotoquímico. É como se uma forte neblina envolvesse a cidade durante o horário de maior insolação ocasionando desconforto visual.
O smog fotoquímico é resultado das reações de NO, radiação solar e NO2 com Compostos Orgânicos Voláteis, resultando na formação de aldeídos, nitrocompostos, aerossóis e oxidantes totais.
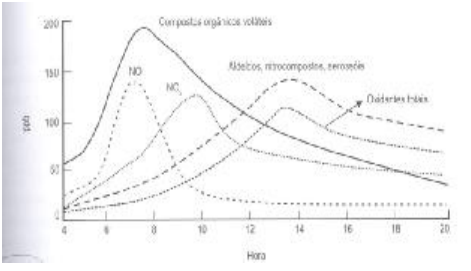
Figura 1 Variação da composição de gases atmosféricos relacionados com o smog fotoquímico ao longo do dia. (Fonte: Introdução à química ambiental. ROCHA, Julio Cesar; COSTA, André H.,CARDOSO; Arnaldo A. 2. ed. Porto Alegre: Bookman, 2009. p. 111).
Com relação à formação do smog fotoquímico,
é incorreto afirmar.
Qual é a concentração de íons cloro na solução final?
• Apresentam caráter covalente; • São compostos binários; • Reagem com água produzindo ácidos; • Reagem com base produzindo sal e água.
Qual é a classe de compostos representados por essas características?
Vários químicos têm se ocupado de pesquisas que mostram o impacto da erosão química de monumentos expostos às chuvas ácidas. A imagem a seguir revela uma estátua feita de rocha calcárea, à base de carbonato de cálcio (CaCO3 ), que sofreu erosão.

Sobre os processos de erosão e a chuva ácida, assinale a alternativa correta.
Na 63ª sessão da Assembleia Geral da Organização das Nações Unidas – ONU – foi aprovado e proclamado, para 2011, o Ano Internacional da Química, conferindo à Organização das Nações Unidas para a Educação, a Ciência e a Cultura – UNESCO – e à União Internacional de Química Pura e Aplicada – IUPAC – a coordenação das atividades mundiais para celebrar as grandes descobertas e os últimos avanços científicos e tecnológicos da química.
Dentre os avanços e descobertas, tem-se a descoberta do fósforo pelo alquimista Henning Brandt e, a partir de então, a fabricação dos palitos de fósforo modernos, que acendem em qualquer lugar: os chamados fósforos de segurança. Eles são armazenados em uma caixa revestida nas laterais por uma cobertura de fósforo vermelho (Pn ) – menos perigoso que o fósforo branco (P4 ) – e sulfeto de antimônio (Sb2 S3 ). A cabeça do fósforo é coberta com clorato de potássio (KClO3 ) e cola e, ao ser riscada na caixa, entra em ignição, liberando energia na forma de fogo.
Sobre as substâncias usadas na fabricação do fósforo de segurança, assinale a alternativa correta.
