Questões de Vestibular
Sobre substâncias e suas propriedades em química
Foram encontradas 879 questões
A ferrugem contém uma substância que é formada pela reação do oxigênio do ar com o ferro presente em uma superfície metálica. Esse processo pode ser representado pela seguinte equação química:
4 Fe(s) + 3 O2 (g) ---- > 2 Fe2 O3 (s)
Nesse processo, o oxigênio sofre a transformação química denominada:
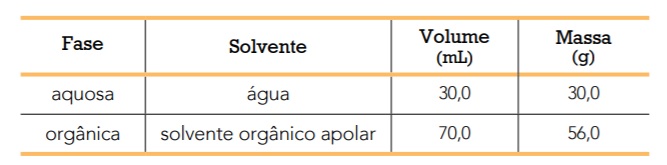
Para diferenciar as duas fases, originariamente incolores, é adicionado ao óleo um corante azul de natureza iônica, que se dissolve apenas na fase em que o solvente apresenta maior afinidade pelo corante. Essa adição não altera as massas e volumes das fases líquidas. As duas fases líquidas do óleo bifásico podem ser representadas pelo seguinte esquema:
Não produzir qualquer tipo de resíduo ou poluente é o principal atributo em favor do hidrogênio como combustível para gerar energia elétrica. Ele faz funcionar células de combustível, equipamentos que produzem eletricidade sem danos ambientais. Como uma das fontes de hidrogênio é a água, uma das alternativas, em consonância com a preocupação ambiental, é o reuso da água como produção de energia renovável, utilizando esgotos e efluentes industriais.
O grupo de professores da Escola de Engenharia de São Carlos/USP desenvolveu um método para produzir hidrogênio em um reator de fluxo contínuo, constantemente alimentado com rejeitos que seriam, muitas vezes, descartados sem tratamento em rios e lagoas. No sistema, bactérias anaeróbicas do gênero Clostridium, que não precisam de oxigênio para viver, aderem a partículas de polietileno dentro de um reator.
Nos automóveis, movidos a células de combustível, o consumo de hidrogênio varia de 1,0 a 10,0g/km rodado, segundo um professor do grupo.
(OLIVEIRA, 2009, p. 100).
Leia o texto para responder à questão.
Lâmpadas sem mercúrio
Agora que os LEDs estão jogando para escanteio as lâmpadas fluorescentes compactas e seu conteúdo pouco amigável ao meio ambiente, as preocupações voltam-se para as lâmpadas ultravioletas, que também contêm o tóxico mercúrio.
Embora seja importante proteger-nos de muita exposição à radiação UV do Sol, a luz ultravioleta também tem propriedades muito úteis. Isso se aplica à luz UV com comprimentos de onda curtos, de 100 a 280 nanômetros, chamada luz UVC, que é especialmente útil por sua capacidade de destruir bactérias e vírus.
Para eliminar a necessidade do mercúrio para geração da luz UVC, Ida Hoiaas, da Universidade Norueguesa de Ciência e Tecnologia, montou um diodo pelo seguinte procedimento: inicialmente, depositou uma camada de grafeno (uma variedade cristalina do carbono) sobre uma placa de vidro. Sobre o grafeno, dispôs nanofios de um semicondutor chamado nitreto de gálio-alumínio (AlGaN). Quando o diodo é energizado, os nanofios emitem luz UV, que brilha através do grafeno e do vidro.
(www.inovacaotecnologica.com.br. Adaptado.)

Analise as estruturas das clorofilas a e b.
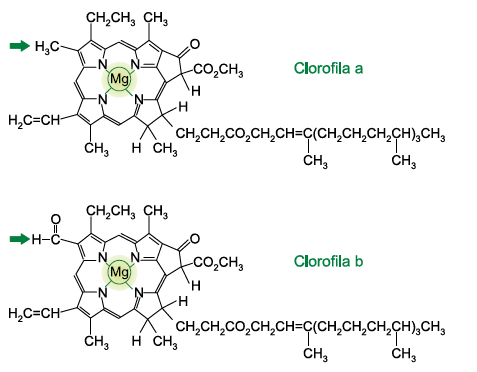
(www.infoescola.com)
As clorofilas a e b estão presentes na estrutura celular denominada __________, sendo que a clorofila ___________é a principal responsável pelo processo de fotossíntese. Nas duas clorofilas, o elemento magnésio encontra-se sob a forma de íons com número de carga _________ . A diferença entre as duas estruturas é a presença, na clorofila b, de um grupo da função orgânica ___________, em vez de um dos grupos metil da clorofila a.
As lacunas do texto são preenchidas, respectivamente, por:
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Figura - Esquema da transformação química da matéria.
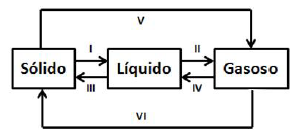 (Fonte: O autor.)
(Fonte: O autor.) Considere os pontos I, II, III, IV, V e VI mostrados na Figura e assinale a alternativa correta em relação ao processo de mudança de fase da matéria.
Segundo Sam Kean, no livro A Colher que
Desaparece, Nabucodonosor II da Babilônia (632
a.C. - 562 a.C.) usou uma mistura de chumbo e
antimônio para pintar as paredes de seu palácio de
amarelo e, pouco depois, enlouqueceu em
consequência da inalação do material utilizado. Sobre
o chumbo e o antimônio, marque a única afirmação
FALSA.
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO QUÍMICO NÚMERO ATÔMICO MASSA ATÔMICA
H 1 1,0
He 2 4,0
Li 3 6,9
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Ne 10 20,2
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Ca 20 40,0
Mn 25 55,0
Co 27 58,9
Zn 30 65,4
Ge 32 72,6
As 33 75,0
Nb 41 93,0
Pb 82 208,0
Cd(s) + NiO2(s) + 2H2O(l) → Cd(OH)2(s) + Ni(OH)2(s).
Considere as seguintes afirmações a respeito dessa reação:
I. O cádmio se oxida.
II. O dióxido de níquel é o agente redutor.
III. O cádmio é o agente oxidante.
IV. O número de oxidação do níquel varia de +4 para +2.
Está correto o que se afirma em
Sobre o carbono e suas formas cristalinas, assinale a única afirmação verdadeira.
DADOS QUE PODEM SER USADOS NESTA PROVA:

DADOS QUE PODEM SER USADOS NESTA PROVA:

DADOS QUE PODEM SER USADOS NESTA PROVA:

Um sistema heterogêneo G é constituído por uma solução verde claro e um sólido marrom. Esse sistema foi submetido ao seguinte esquema de separação:
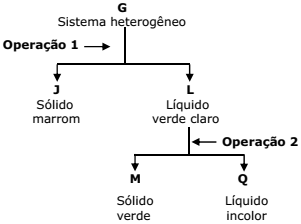
Ao destilar-se o líquido Q sob pressão constante de 1 atmosfera, verifica-se que sua temperatura de ebulição variou entre 115 °C e 130 °C.
Considerando o esquema acima, assinale a
afirmação verdadeira.
ELEMENTO NÚMERO MASSA
QUÍMICO ATÔMICO ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Na 11 23,0
Si 14 28,1
P 15 31,0
S 16 32,0
Cl 17 35,5
K 19 39,0
Cr 24 52,0
Cu 29 63,5
As 33 75,0
Br 35 80,0
Ag 47 108,0
Sn 50 119,0
Ir 77 192,0
Au 79 197,0
Hg 80 200,0
O composto é o _______________________1 e a geometria de sua molécula é _______________2 .
