Questões de Vestibular
Sobre substâncias e suas propriedades em química
Foram encontradas 879 questões
A partir da concepção de Robert Boyle e do conceito moderno de elemento químico, é correto afirmar:

Considerando a sequência de fenômenos sobre a água representados nos quadrinhos, é CORRETO afirmar:
São dadas três substâncias:
I - água
II - gás carbônico
III - trióxido de enxofre
Assinale a alternativa em que são determinadas,
respectivamente, a polaridade e a geometria das
moléculas constituintes das substâncias.
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
As moléculas de CH4
e CCl4
possuem momento dipolar permanente.
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
A geometria da molécula do SF6 é octaédrica.
As propriedades físico-químicas das substâncias são afetadas pelas interações intra e intermoleculares.
Com base nos conhecimentos de química e nos dados da tabela, é correto afirmar:
O SO2 é uma molécula apolar, pois possui geometria linear.
Em 18 de Fevereiro de 2015, o Google Doodle fez uma homenagem ao 270o aniversário do inventor da pilha elétrica, Alessandro Volta, um físico italiano que tinha como uma de suas paixões a eletricidade. A unidade elétrica volt é uma homenagem a esse inventor.
Volta também estudou Química, essa ciência teve grande importância no que diz respeito à pilha elétrica.

<http://tinyurl.com/m5dagtf> Acesso em: 20.02.2015. Adaptado. Original colorido.
Na imagem, podemos observar uma pilha e duas semirreações que representam os processos de oxidação e de redução,
envolvidos na confecção dessa pilha, cujos potenciais padrão de redução são:
I. Zn2+/Zn: - 0,76 V
II. 2H+/H2 : 0,00 V
Um dos materiais usados na confecção da pilha é o zinco, cujo símbolo é Zn e apresenta
• Número atômico: 30
• Massa atômica: 65,4 u
• Ponto de fusão: 419,5 °C
• Ponto de ebulição: 907 °C
• Configuração por camadas:
K L M N
2 8 18 2
As propriedades dos compostos químicos são funções das ligações entre os átomos formadores da molécula, da geometria e da polaridade molecular. Com relação aos compostos: CO2, SO2, CH4, NaBr e HF, verifique as proposições abaixo.
I. O CO2 é uma molécula linear e polar.
II. O SO2 é uma molécula angular e polar.
III.O CH4 é uma molécula piramidal e apolar.
IV.O NaBr é um composto iônico.
V. O HF é uma molécula que apresenta pontes de hidrogênio.
São verdadeiras, apenas, as proposições
Sobre esse processo, é correto afirmar:
Texto adaptado de http://sustentabilidade.estadao.com.br/noticias/geral,poluicao-do-arem-sao-paulo-e-duas-vezes-o-limite-da-oms,10000050538 Acesso em 23 de agosto de 2017.
Acerca dos compostos mencionados no fragmento de texto acima, é possível afirmar que:
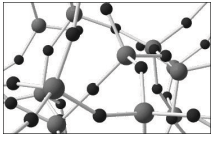 A substância representada por esse modelo
tridimensional pode ser
A substância representada por esse modelo
tridimensional pode ser Considere 4 frascos, cada um contendo diferentes substâncias, a saber:
Frasco 1: 100 mL de H2O(l)
Frasco 2: 100 mL de solução aquosa de ácido acético de concentração 0,5 mol/L
Frasco 3: 100 mL de solução aquosa de KOH de concentração 1,0 mol/L
Frasco 4: 100 mL de solução aquosa de HNO3 de concentração 1,2 mol/L
A cada um desses frascos, adicionaram-se, em experimentos distintos, 100 mL de uma solução aquosa de HCl de concentração 1,0 moI/L. Medindo-se o pH do líquido contido em cada frasco, antes e depois da adição de HCl(aq), pôde-se observar aumento do valor do pH somente








As ligações químicas realizadas entre átomos conferem às subtâncias diferentes propriedades químicas e físicas.
Sobre os tipos de ligações, assinale a alternativa que apresenta, correta e respectivamente, as ligações químicas nas substâncias NaH, FeCℓ3, diamante, Sn (estanho), polietileno e HNO3.
Leia o trecho do soneto “Como eu te amo”, de Gonçalves Dias, para responder a questão.
<https://tinyurl.com/y6uoquu5> Acesso em: 17.03.2018. Adaptado.
A condensação, passagem de uma substância do estado gasoso para o estado líquido, pode ocorrer quando vapores de um material entram em contato com uma superfície fria.
O verso que cita um fenômeno resultante da condensação
do vapor de água é o

