Questões de Vestibular
Sobre substâncias e suas propriedades em química
Foram encontradas 879 questões
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
Atente para os seguintes antioxidantes e as indicações em negrito.
I. Licopeno: C4H6 – CH2 – C35H48 (átomo de carbono) II. Vitamina A: C18H26 = CH – CH2 – OH (átomo de carbono)
A soma dos números de oxidação dos átomos indicados acima é
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
QUÍMICO ATÔMICO
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Fe 26 56,0
Cu 29 63,5
Zn 30 65,4
Ag 47 108,0
Sn 50 119,0
Xe 54 131,0
W 74 184,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
DADOS QUE PODEM SER USADOS NESTA PROVA:
ELEMENTO NÚMERO MASSA ATÔMICA
H 1 1,0
C 6 12,0
N 7 14,0
O 8 16,0
F 9 19,0
Si 14 28,0
S 16 32,0
Cl 17 35,5
Ca 20 40,0
Mn 25 55,0
Fe 26 56,0
Br 35 80,0
Rb 37 85,5
Zr 40 91,0
Ag 47 108,0
Cd 48 112,5
Ba 56 137,0
Pb 82 207,0
U 92 238,0
Pu 94 244,0
Observe a reação a seguir:
5C6H12O6 + 24NO-3 + 24H+ → 30CO2 + 42H2O + 12N2 + energia
Essa reação trata-se basicamente de um processo de respiração anaeróbica realizada por bactérias
ASSINALE o tipo de sistema produzido pelos componentes água e álcool e a forma de transmissão do calor do sol para esse sistema:
O NOx é o principal causador da chuva ácida. A seguir temos três reações que produzem NOx:
I - N2+ O2 → 2NO
II - 2NO + O2 → 2NO2
III - 2NO2+ O2 → 2NO3
ASSINALE a alternativa que contém a informação correta sobre o número de oxidação do Nitrogênio em cada reação.
I- Sua Geometria é angular. II- Forma Ligações de Pontes de Hidrogênio. III- Solubiliza substâncias de baixa polaridade como, por exemplo, os óleos. IV- Apresenta ligações tipo covalentes polarizadas. V- Apresenta-se nos três estados físicos da matéria.
Um joalheiro bastante experiente lapidou um pedaço de vidro e um diamante do mesmo tamanho, cortando-os em inúmeras facetas e, a seguir, os poliu de forma a ficarem idênticos. Contudo, o vidro não apresenta o mesmo brilho do diamante ao ser incidido pela luz.
Fonte: SOUZA, Líria Alves de. "Brilho do diamante"; Brasil Escola. Disponível em <https://brasilescola.uol.com.br/quimica/brilho-diamante.htm>. Acesso em 20 de maio de 2018. (adaptado)
O vidro, mesmo após todo esse processo, não exibe o mesmo brilho pois o diamante é um sólido
As temperaturas de fusão e ebulição são propriedades específicas dos materiais e muito importantes para sua identificação. Essas propriedades dependem do tipo de interação intermolecular e da massa molar das substâncias.
Considere estas substâncias:

Dessas substâncias a que apresenta menor ponto de fusão é:
Analise este rótulo de uma embalagem comercial de óleo de soja, um dos alimentos mais consumidos pela população brasileira.
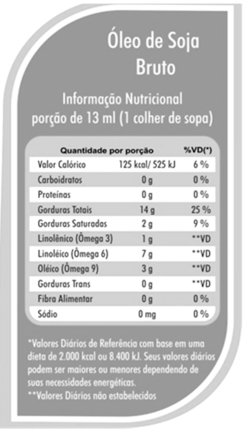
Fonte:: http://www.oleosdobrasil.com.br/ - Acesso em 29 de Fevereiro de 2016.
Ao analisar esse rótulo, é CORRETO afirmar que óleo de soja é
1 - A substância apresenta altos pontos de fusão e ebulição; 2 - A substância conduz energia elétrica no estado sólido.
ASSINALE a alternativa que indica a substância testada pelo estudante.
