Questões de Vestibular
Sobre substâncias inorgânicas e suas características: ácidos, bases, sais e óxidos. reações de neutralização. em química
Foram encontradas 378 questões
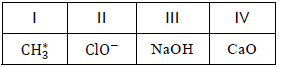
Em relação às informações que as fórmulas químicas oferecem, é correto afirmar:
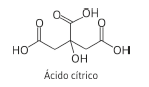
O ácido cítrico pode ser utilizado para a descalcificação de máquinas de café espresso porque reage com o carbonato de cálcio formando
Leia o texto abaixo e assinale a alternativa que apresenta corretamente os termos que estão faltando nas lacunas, respeitando a sequência em que estas aparecem no texto.
Brasil será um dos campeões da mortalidade
cardiovascular em 2040; portanto, cuidado com o sal
Bate certa culpa – e receio – na hora de pegar o saleiro e despejar o pozinho branco sobre a comida? É bem provável que sim, principalmente se você é do tipo que se interessa e lê sobre nutrição e saúde. Afinal, não é de hoje que médicos alertam que o componente, em excesso, aumenta o risco de doenças do coração, especialmente a pressão alta, também conhecida como hipertensão. O Brasil deverá ocupar o posto de campeão de mortalidade cardiovascular em 2040, entre os países emergentes, de acordo com dados da OMS (Organização Mundial da Saúde). Mas não é o caso de eliminar totalmente o sal da alimentação. Ele tem sua importância para a saúde. “O sal de cozinha tradicional, ou cloreto de sódio, é composto por _______, mineral que representa o principal íon positivo dos fluidos corporais, e ________, íon negativo. Ambos têm funções importantes, como conter a pressão osmótica, quer dizer, o volume de água que passa através da membrana celular.
(Fonte: Disponível em: www.uol.com.br. Acesso em 3/10/2012)
O permanganato de potássio é uma substância vendida, até hoje, em farmácias e drogarias,para tratamento de afecções cutâneas em crianças, tais como a catapora, quando é usada uma solução muito diluída deste forte oxidante antisséptico.
A fórmula do permanganato de potássio é KMnO4.
Análise as afirmativas a respeito desta substância e escolha a alternativa correta.

Queixas chegaram à Vigilância Sanitária Estadual e foram relatadas por moradores de Canoas, São Leopoldo e Porto Alegre
Na zona sul da Capital, uma menina de 10 anos foi levada ao Hospital de Pronto Socorro (HPS) depois que sentiu uma forte ardência na boca e na garganta ao beber o produto, comprado pela avó dela, que é dona de um minimercado no bairro Guarujá. A garota foi medicada e retornou para casa nesta tarde. Segundo a responsável pelo setor de alimentos da Divisão de Vigilância Sanitária do Estado, Susete Lobo Saar de Almeida, uma análise laboratorial prévia do produto constatou alterações no pH da bebida. Esse índice, que aponta o quanto uma substância é ácida ou alcalina, estaria em torno de 13 — em uma escala que vai de zero a 14 — indicando grande alcalinidade no produto.
Fonte: http://zerohora.clicrbs.com.br
Qual das substâncias abaixo poderia ter causado o problema citado na reportagem?
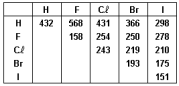
Analise as afirmações seguintes.
I. Dentre os compostos HX, o HF é o ácido mais fraco e a sua ligação H-X é a mais forte. II. A distância de ligação entre os átomos nas moléculas X2 é maior no I2, já que a sua energia de ligação é a mais fraca. III. A molécula com maior momento dipolar é o HI.
Está correto o contido em
A partir da análise dos efeitos causados pelo cloreto de sódio sobre o aumento da pressão arterial no Brasil, é correto afirmar:
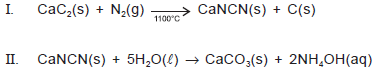
Quando carbeto de cálcio, CaC2, é aquecido em um forno elétrico, na presença de nitrogênio atmosférico, a 1100°C, dá origem à cianamida de cálcio, empregada largamente como fertilizante nitrogenado de ação lenta, pois leva alguns meses, no solo, para se hidrolisar de acordo com a equação química II. Como a cianamida de cálcio não é arrastada pelas chuvas, é um fertilizante melhor do que o nitrato de amônio, NH4NO3, e a ureia, CO(NH2)2.
Uma análise dessas informações permite afirmar:
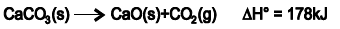
O calcário formado principalmente por carbonato de cálcio, CaCO3 (s), é um mineral importante na correção da acidez do solo, na produção de cimento e de óxido de cálcio CaO, conhecido como cal.
O Brasil utiliza cerca de um milhão de toneladas de óxido de cálcio por ano. A partir da decomposição térmica do carbonato de cálcio representada pela equação química, é correto afirmar:
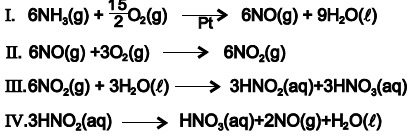
Com base nessas informações e de acordo com as equações químicas que representam o processo de fabricação do ácido nítrico, é correto afirmar:
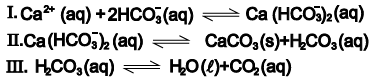
As algas zooxanthellae são também responsáveis pela intensa precipitação de carbonatos no esqueleto dos corais escleractíneos principais formadores dos recifes. Em pH próximo a 8,5, a maior parte do CO2 (aq) disponível na água do mar se encontra na forma de íons bicarbonato, HCO3- (aq). Devido à intensa radiação solar, os corais e os invertebrados que possuem algas simbiontes — sensíveis a pequenas alterações de temperatura — capturam ativamente íons de cálcio, Ca2+(aq), que reagem com íons bicarbonato.O bicarbonato de cálcio se decompõe em carbonato de cálcio, que se precipita sob forma de esqueleto, e ácido carbônico, H2CO3 (aq), usado na fotossíntese. Trata-se de um processo bioquímico muito eficiente, porém sujeito às alterações das concentrações de CO2 (g), na atmosfera.
Uma análise do processo bioquímico de formação de esqueleto de carbonato de cálcio dos corais escleractíneos referidos no texto e de acordo com as equações químicas I, II e III, permite afirmar:
Sobre esse ácido, é correto afirmar:

Assim, considerando-se essas informações e os dados de decomposição de um determinado óxido de nitrogênio, NOx, relacionados na tabela, é correto afirmar:

II) A amônia é um composto gasoso de caráter básico.
III) O ácido nítrico é um oxiácido monoprótico.
IV) Na amônia, o nitrogênio tem número de oxidação +3.
V) A reação que ocorre na etapa 6 é homogênea.
A sequência correta que corresponde, respectivamente, à questão é
Assinale a sequência que identifica corretamente os cinco gases:
