Questões de Vestibular de Química - Termoquímica: Energia Calorífica, Calor de reação, Entalpia, Equações e Lei de Hess.
Foram encontradas 80 questões
A tabela mostra valores do pH da água líquida em diferentes temperaturas.
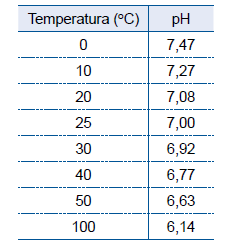
A análise desses dados permite afirmar que o produto iônico da água, Kw,_______ com a elevação da temperatura e que a reação de autoionização da água _______ energia, sendo, portanto, um processo _______.
As lacunas do texto devem ser preenchidas por:
Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 . Considere os valores das entalpias de formação indicados na tabela. Uma das maneiras de se obter industrialmente o hidrogênio é pelo processo conhecido como “reforma de hidrocarbonetos a vapor”, que envolve a reação entre hidrocarboneto e água no estado gasoso, gerando como produtos gasosos CO e H2 .
Considere os valores das entalpias de formação indicados na tabela.
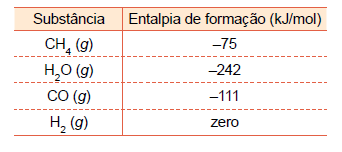
A partir das informações fornecidas, calcula-se que a produção
de cada mol de hidrogênio pela reforma a vapor do metano
Compressas de emergência quentes são usadas como primeiro socorro em contusões sofridas em práticas esportivas. Essa compressa constitui-se de um saco de plástico contendo uma ampola de água e um produto químico seco, por exemplo, o cloreto de cálcio (CaCℓ2 ). Com uma leve pancada, a ampola se quebra e o cloreto de cálcio se dissolve, conforme a reação representada pela equação:
CaCℓ2 (s) + H2 O (ℓ) → CaCℓ2 (aq) ∆H = −82,7 kJ/mol
Nesse processo,
I. H2(g) + O2(g) ⇾ H2O(l) ΔH = -68 Kcal/mol II. C(g) + O2(g) ⇾ CO2(g) ΔH = -94 Kcal/mol III.C2H5OH(l) + O2(g) ⇾ CO2(g) + H2O(l) ΔH = -327 Kcal/mol
A entalpia de formação do etanol será:
