Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 724 questões

A tabela acima apresenta a porcentagem, em massa, dos
componentes mais abundantes em uma amostra de mel e suas
respectivas massas molares. Além desses, foram identificados
outros componentes como o ácido metanoico e o ácido etanoico.
Considerando essas informações, julgue os itens que se seguem.
Nos estados eletrônicos fundamentais, os elétrons dos íons K+ e Cl - ocupam o mesmo número de níveis de energia.
O átomo de potássio, por ser menor que o átomo de sódio (Na), apresenta a primeira energia de ionização maior que a do átomo de Na.
Quantos elétrons são produzidos a partir da oxidação de 460 μg de etanol no interior de um bafômetro informado no texto acima.?
Dado: número de Avogrado: 6.1023 CH3CH2OH = 46 g/mol
Fe(s) + 2 HCl(aq) → FeCl2(aq) + H2(g)
Então, na temperatura de 25 ºC e pressão de 1 atm, o volume de gás hidrogênio, considerado gás ideal, para inflar o balão foi de aproximadamente:
Dados:
Massas Molares (g.mol-1): H = 1,0; Cl = 35,5 e Fe = 56,0; R = 0,082 L.atm.K-1.mol-1 (Constante Universal dos Gases); T (K) = T(ºC) + 273.
A partir do conhecimento dessas relações, é correto afirmar
Existe vida de uma forma completamente diferente de tudo que se conhece até agora. A descoberta revelada pela Nasa é de uma bactéria que pertence ao grupo das halomonodáceas, que vive nas águas salgadas e ricas em arsênio do lago Mono, na Califórnia. A bactéria é uma forma de vida que incorpora no DNA, no lugar do fósforo, um elemento químico tóxico que não deveria fazer parte, em tese, da química da vida: o arsênio.
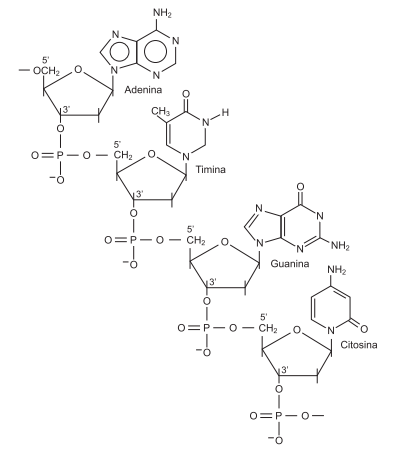
Uma análise dessas informações e da sequência de nucleotídeos do DNA, representada pela estrutura na figura, permite afirmar:
Com base nessas considerações e comparando-se as propriedades dos elementos químicos rubídio e iodo, é correto afirmar:


 NH4OH(aq)
NH4OH(aq)  NH+4 (aq) + OH− (aq)
NH+4 (aq) + OH− (aq)
Em relação ao mercúrio (Z=80) e ao texto acima, considere as afirmações I, II, III e IV abaixo.
I. É um elemento químico, cujo número de oxidação é variável, podendo ser, em sua forma iônica, monovalente positivo ou bivalente positivo.
II. É o elemento de símbolo químico Hm.
III. É um não-metal que difere fisicamente dos demais por apresentar-se no estado líquido a 1 atm de pressão e 25º C de temperatura.
IV. É tóxico, tendo efeito cumulativo no organismo humano.
São INCORRETAS, apenas, as afirmações
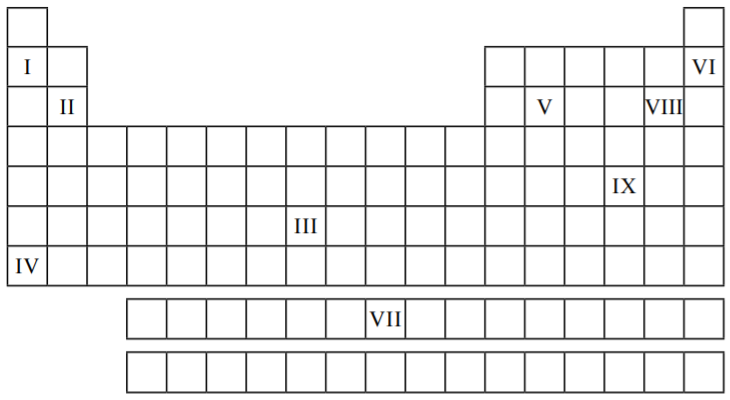
A respeito de tais elementos é correto afirmar que
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô, percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
a reação entre o dióxido de carbono e o óxido de cobre (II) envolve um processo de
oxirredução.
Depois de terem percorrido cerca de 80 km, os dois amigos param para abastecer o carro. Após o
abastecimento, Carlos tenta dar partida no veículo, porém nada acontece. Como o carro tem mais
de 20 anos, ele não se surpreende e desce do mesmo para dar uma olhada. Ao abrir o capô,
percebe que há um acúmulo de material azul esverdeado (zinabre) envolvendo os eletrodos da
bateria.
Dado: o zinabre é uma mistura de CuCO3 e Cu(OH)2.
Sobre o assunto, é CORRETO afirmar que:
o carbonato de cobre (II) resulta da reação entre CuO e CO2 presentes no ar.
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
Chumbo, polônio, urânio e tório ocupam o sexto período da tabela periódica.
