Questões de Vestibular
Sobre transformações químicas: elementos químicos, tabela periódica e reações químicas em química
Foram encontradas 724 questões
Em abril de 1898, Marie Sklodowska Curie (1867-1934) e Pierre Curie (1859-1906), ao processar a pechblenda obtiveram duas frações radioativas. Uma delas apresentou uma radioatividade 400 vezes maior que a do urânio. O casal Curie associou essa radioatividade a um novo elemento químico, o qual foi denominado polônio, em homenagem à Polônia, terra natal de Marie Curie. O polônio foi o terceiro elemento radioativo identificado, depois do urânio e do tório, o que levou Marie Curie a receber o Prêmio Nobel de Química em 1911.
Na natureza há sete isótopos naturais do polônio, representados por: 210Po, 211Po, 212Po, 214Po, 215Po, 216Po e 218Po. Todos os isótopos desse elemento desintegram-se por emissão de partículas alfa, produzindo isótopos de chumbo. A elevada energia das partículas alfa emitidas pelo polônio permite a identificação de diminutas quantidades desse elemento em uma amostra. O polônio se dissolve em ácidos diluídos produzindo soluções contendo íons Po2+ .
Considere as informações acima e assinale a proposição CORRETA.
O cátion Po2+ apresenta 86 elétrons.
O seu traje habitual era, como o de todas as mulheres da sua condição e esfera, uma saia de lila preta, que se vestia sobre um vestido qualquer, um lenço branco muito teso e engomado ao pescoço, outro na cabeça (...). Nos dias dúplices, em vez de lenço à cabeça, o cabelo era penteado, e seguro por um enorme pente cravejado de crisólitas.
ALMEIDA, Manuel Antônio de. Memórias de um sargento de milícias. São Paulo:
Ática, 2003. p. 30.
A crisólita é um silicato de ferro e magnésio que tem fórmula geral (Mg, Fe)2SiO4, cujas colorações variam do amarelo ao verde. Possui teor de ferro de 10 a 30%, sendo utilizada na fabricação de refratários e em joalheria.
Dados os valores de energia de ionização (EI) em kJ mol-1 para:
magnésio: EI1 = 738; EI2 = 1450
silício: EI1 = 786; EI2 = 1580
De acordo com as informações acima, assinale a proposição CORRETA.
Átomos de magnésio apresentam configuração eletrônica igual a do íon Si4+
O seu traje habitual era, como o de todas as mulheres da sua condição e esfera, uma saia de lila preta, que se vestia sobre um vestido qualquer, um lenço branco muito teso e engomado ao pescoço, outro na cabeça (...). Nos dias dúplices, em vez de lenço à cabeça, o cabelo era penteado, e seguro por um enorme pente cravejado de crisólitas.
ALMEIDA, Manuel Antônio de. Memórias de um sargento de milícias. São Paulo:
Ática, 2003. p. 30.
A crisólita é um silicato de ferro e magnésio que tem fórmula geral (Mg, Fe)2SiO4, cujas colorações variam do amarelo ao verde. Possui teor de ferro de 10 a 30%, sendo utilizada na fabricação de refratários e em joalheria.
Dados os valores de energia de ionização (EI) em kJ mol-1 para:
magnésio: EI1 = 738; EI2 = 1450
silício: EI1 = 786; EI2 = 1580
De acordo com as informações acima, assinale a proposição CORRETA.
A energia de ionização refere-se à quantidade de energia necessária para remover um
elétron de átomo, íon ou molécula.
O seu traje habitual era, como o de todas as mulheres da sua condição e esfera, uma saia de lila preta, que se vestia sobre um vestido qualquer, um lenço branco muito teso e engomado ao pescoço, outro na cabeça (...). Nos dias dúplices, em vez de lenço à cabeça, o cabelo era penteado, e seguro por um enorme pente cravejado de crisólitas.
ALMEIDA, Manuel Antônio de. Memórias de um sargento de milícias. São Paulo:
Ática, 2003. p. 30.
A crisólita é um silicato de ferro e magnésio que tem fórmula geral (Mg, Fe)2SiO4, cujas colorações variam do amarelo ao verde. Possui teor de ferro de 10 a 30%, sendo utilizada na fabricação de refratários e em joalheria.
Dados os valores de energia de ionização (EI) em kJ mol-1 para:
magnésio: EI1 = 738; EI2 = 1450
silício: EI1 = 786; EI2 = 1580
De acordo com as informações acima, assinale a proposição CORRETA.
Na tabela periódica, a primeira energia de ionização cresce de baixo para cima nos
períodos.
O seu traje habitual era, como o de todas as mulheres da sua condição e esfera, uma saia de lila preta, que se vestia sobre um vestido qualquer, um lenço branco muito teso e engomado ao pescoço, outro na cabeça (...). Nos dias dúplices, em vez de lenço à cabeça, o cabelo era penteado, e seguro por um enorme pente cravejado de crisólitas.
ALMEIDA, Manuel Antônio de. Memórias de um sargento de milícias. São Paulo:
Ática, 2003. p. 30.
A crisólita é um silicato de ferro e magnésio que tem fórmula geral (Mg, Fe)2SiO4, cujas colorações variam do amarelo ao verde. Possui teor de ferro de 10 a 30%, sendo utilizada na fabricação de refratários e em joalheria.
Dados os valores de energia de ionização (EI) em kJ mol-1 para:
magnésio: EI1 = 738; EI2 = 1450
silício: EI1 = 786; EI2 = 1580
De acordo com as informações acima, assinale a proposição CORRETA.
Os valores de energia de ionização sugerem que é mais fácil remover o segundo elétron do
magnésio que do silício.
O seu traje habitual era, como o de todas as mulheres da sua condição e esfera, uma saia de lila preta, que se vestia sobre um vestido qualquer, um lenço branco muito teso e engomado ao pescoço, outro na cabeça (...). Nos dias dúplices, em vez de lenço à cabeça, o cabelo era penteado, e seguro por um enorme pente cravejado de crisólitas.
ALMEIDA, Manuel Antônio de. Memórias de um sargento de milícias. São Paulo:
Ática, 2003. p. 30.
A crisólita é um silicato de ferro e magnésio que tem fórmula geral (Mg, Fe)2SiO4, cujas colorações variam do amarelo ao verde. Possui teor de ferro de 10 a 30%, sendo utilizada na fabricação de refratários e em joalheria.
Dados os valores de energia de ionização (EI) em kJ mol-1 para:
magnésio: EI1 = 738; EI2 = 1450
silício: EI1 = 786; EI2 = 1580
De acordo com as informações acima, assinale a proposição CORRETA.
O silício possui dois elétrons na camada de valência.
Disponível em: (Adaptado) Acesso em 07 - jun-2011.
(Dados - massas molares: Na = 23g/mol; H = 1g/mol; O = 16g/mol; C = 12g/mol; S = 32g/mol)
De acordo com o texto e com os seus conhecimentos, é correto afirmar que:
Com base nos conhecimentos dos modelos atômicos e nas propriedades periódicas dos elementos químicos, é correto afirmar:
Al2(SO4)3 + 6H2O → 2Al(OH)3 + 6 H+ + 3SO42-
O excesso de íons H+ formado tende a diminuir o pH do meio, o que pode contribuir para a interrupção da formação do Al(OH)3, atrapalhando o processo de coagulação/floculação. Em alguns casos, o excesso de H+ é removido pela alcalinidade presente nas águas naturais. Se a alcalinidade do meio não for suficiente, o pH deve ser aumentado pela adição de outras substâncias. Disponível em: <http://qnesc.sbq.org.br/online/cadernos/01/aguas.pdf> Acesso em: 1 nov. 2011 (adaptado).
É possível aumentar o pH do meio aquoso adicionando-se a seguinte substância:
I. O raio do Li+ é menor do que o raio do Li, pois o primeiro apresenta um elétron a menos. II. Os íons Na+, F– e Mg²+ têm a mesma configuração eletrônica, porém, seus raios são diferentes porque eles têm diferentes números atômicos. III. O raio dos ânions é maior do que o raio dos átomos originais devido ao aumento do número de elétrons na camada de valência dos ânions e aos efeitos de repulsão que os elétrons exercem uns sobre os outros. IV. O raio iônico diminui de cima para baixo em um mesmo grupo na tabela periódica devido ao aumento sucessivo do número de camadas eletrônicas.
Estão corretas as afirmações em
A maioria dos elementos da tabela periódica apresenta-se como metais quando cristalizados na sua substância pura. Suas propriedades químicas são alvos tanto da pesquisa quanto da aplicação industrial. Por pertencerem a uma mesma classe, os metais possuem características similares. Sobre as características dos metais, considere as seguintes afirmativas:
1. Metais apresentam alta condutividade térmica e elétrica.
2. Metais possuem altos valores de eletronegatividade.
3. Metais apresentam baixa energia de ionização.
4. Metais reagem espontaneamente com oxigênio.
Assinale a alternativa correta.
Na versão moderna da tabela periódica dos elementos, estes são organizados em grupos e períodos. A posição de cada elemento na tabela deve-se à sua estrutura eletrônica e, como resultado, as propriedades químicas ao longo de um grupo são bastante similares.
A seguir são fornecidas informações sobre as propriedades químicas, além da ocorrência natural, relacionadas a elementos representativos. Quanto a isso, numere a coluna da direita de acordo com sua correspondência com a da esquerda.
1. Encontrado na natureza em rochas e minerais argilosos. Possui quatro elétrons na camada de valência. O produto da reação da substância pura com oxigênio produz um sólido insolúvel, cuja temperatura de fusão é ~1700 °C.
2. Produzido industrialmente pelo resfriamento do ar. Sua substância pura é bastante inerte em função da tripla ligação que une os átomos.
3. Encontrado em minerais que ocorrem em áreas vulcânicas, sendo o mineral primário a ulexita. É largamente utilizado na fabricação de vidros.
4. Não é encontrado na natureza na forma elementar, mas somente combinado com outros elementos. Ocorre na crosta terrestre na forma de rochas. Tanto sua substância pura quanto seu hidreto apresentam-se como moléculas binárias contendo uma única ligação simples. Em condição ambiente, ambos são gases corrosivos.
5. Ocorre na natureza principalmente na forma combinada em rochas, sendo a pirita uma das principais fontes comerciais. No entanto, o gás natural e o xisto também são fontes naturais desse elemento. Ocorre na natureza em pelo menos 5 estados de oxidação, que são: -2, -1, 0, +4 e +6.
( ) Boro.
( ) Silício.
( ) Flúor.
( ) Nitrogênio.
( ) Enxofre.
Assinale a alternativa que apresenta a numeração correta na coluna da direita, de cima para baixo.
Na 63ª sessão da Assembleia Geral da Organização das Nações Unidas – ONU – foi aprovado e proclamado, para 2011, o Ano Internacional da Química, conferindo à Organização das Nações Unidas para a Educação, a Ciência e a Cultura – UNESCO – e à União Internacional de Química Pura e Aplicada – IUPAC – a coordenação das atividades mundiais para celebrar as grandes descobertas e os últimos avanços científicos e tecnológicos da química.
Dentre os avanços e descobertas, tem-se a descoberta do fósforo pelo alquimista Henning Brandt e, a partir de então, a fabricação dos palitos de fósforo modernos, que acendem em qualquer lugar: os chamados fósforos de segurança. Eles são armazenados em uma caixa revestida nas laterais por uma cobertura de fósforo vermelho (Pn ) – menos perigoso que o fósforo branco (P4 ) – e sulfeto de antimônio (Sb2 S3 ). A cabeça do fósforo é coberta com clorato de potássio (KClO3 ) e cola e, ao ser riscada na caixa, entra em ignição, liberando energia na forma de fogo.
Sobre as substâncias usadas na fabricação do fósforo de segurança, assinale a alternativa correta.
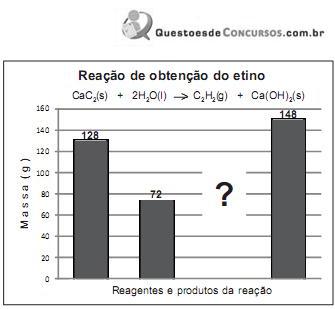
A massa, em gramas, de etino obtido nessa reação, que corresponde à coluna representada pelo ponto de interrogação, é
“No verão de 1774, Joseph Priestley, na Inglaterra, descobriu que quando se aquecia cal de mercúrio (óxido de mercúrio) ao rubro, dela desprendia um “ar” que, surpreendentemente, parecia ainda mais forte ou mais puro do que o ar comum. [...] Fascinado, Priestley investigou mais a fundo, descobrindo que camundongos podiam viver naquele ar ar por um tempo quatro vezes maior do que o ar comum. E assim, convencido de que aquele “novo” ar era benigno, ele próprio o experimentou.”
SACHS, Oliver. Tio Tungstênio. São Paulo: Companhia das Letras, 2002. P. 114.
O “novo ar” de que trata o texto é constituído essencialmente do elemento químico que
Com base nessas informações, é correto afirmar que