Questões de Vestibular PUC - RJ 2016 para Vestibular - 2º Dia Grupo 2
Foram encontradas 30 questões
Considere as seguintes afirmativas a respeito da substância representada:
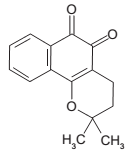
I - Possui fórmula molecular C15H14O2 .
II - Possui 6 ligações pi (π).
III - Possui 4 carbonos terciários.
É correto o que se afirma em
Considere as seguintes afirmativas referentes ao elemento químico cobalto.
I - Seus átomos eletricamente neutros possuem configuração eletrônica [Ar]4s23d7.
II - Está localizado no 4° período da tabela periódica e é um elemento representativo.
III - Quando um átomo deste elemento químico perde dois elétrons, ele se torna um ânion divalente.
É correto o que se afirma em
Duas soluções aquosas de NaOH, cada uma com 250 mL, foram preparadas a 25 °C para que uma tivesse concentração de 0,1 mol L-1 enquanto a outra fosse 0,5 mol L-1 .
Ao se misturarem as duas soluções, obtêm-se 500 mL de uma solução final, cuja concentração em quantidade de matéria (mol L-1 ) é:
A seguir, são representas as estruturas químicas de duas substâncias psicoativas.
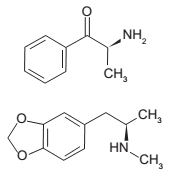
Em ambas as substâncias está presente a função
orgânica
Uma solução, na qual o soluto é uma substância inorgânica, foi preparada com água pura (pH 7). Contudo, devido a um descuido, a mesma não foi rotulada. Na tentativa de identificá-la através do seu caráter ácido ou básico, mediu-se o pH, e o valor observado foi 2.
Das opções abaixo, o único soluto que poderia compor a solução é o
Uma quantidade equivalente, em mol, de dois gases, nitrogênio e oxigênio, é colocada num recipiente rígido de 2,0 L.
Nesse sistema,
A pilha seca tem potencial padrão de 1,5 V e consiste de um anodo de zinco e um catodo de dióxido de manganês. O meio eletrolítico é uma pasta umedecida contendo carvão, cloreto de amônio e cloreto de zinco. A equação química da reação espontânea que ocorre da pilha é a seguinte:
Zn(s) + 2 MnO2(aq) + 2 NH4 + (aq) → Zn2+(aq) + Mn2 O3(s) + 2 NH3(g) + H2 O(aq)
A variação no valor de Nox na semirreação de redução é de
Em cada par representado a seguir, com fórmulas moleculares C2H5BrO, C4H6Br2 e C6H7NO, existem diferentes tipos de isomeria.
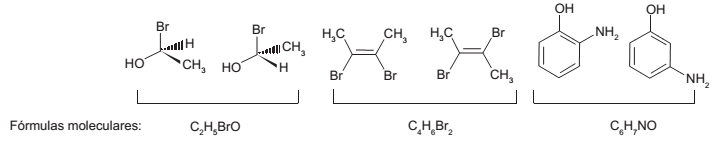
Com relação aos pares, é certo que nos que possuem fórmula molecular
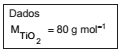
O titânio é obtido a partir do mineral rutilo (TiO2 ) em duas etapas: a primeira, formando cloreto de titânio a 1000 °C (Equação I); e a segunda, usando magnésio para promover a redução e obter o titânio (Equação II).
TiO2(s) + 2 C(s) + 2 Cl2(g) → TiCl4(g) + 2CO(g) (Equação I)
TiCl4(l) + 2 Mg(s) → Ti(s) + 2 MgCl2(l) (Equação II)
Considere que 6,0 ton de minério produziram massa igual a 2,4 ton de Ti, considerando as reações completas. A porcentagem (valor arredondado mais próximo) de TiO2 originalmente no minério é:
Um estudante misturou 100 mL de solução de H2SO4 0,10 mol L-1 com 100 mL de solução aquosa de NaOH 0,050 mol L-1 .
Sobre a reação e seu resultado, obteve-se: