Questões de Vestibular UEFS 2009 para Vestibular, Física, Química e Biologia
Foram encontradas 60 questões
De acordo com essas considerações e destacando-se o átomo de zircônio, 40Zr — um metal utilizado no revestimento de metais e de fornos —, é correto afirmar
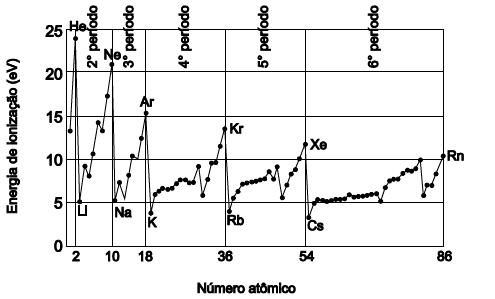
A energia de ionização de um átomo é uma propriedade periódica, cuja unidade de medida é o eletronvolt, eV, que é a energia mínima necessária para se retirar um elétron de um átomo gasoso, no estado fundamental. O gráfico representa a variação dos valores dos primeiros potenciais de ionização em função do número atômico.
Uma análise dessas informações e com base nesse gráfico, pode-se concluir:

Assim, considerando-se essas informações e os dados de decomposição de um determinado óxido de nitrogênio, NOx, relacionados na tabela, é correto afirmar:
Sobre esse ácido, é correto afirmar:
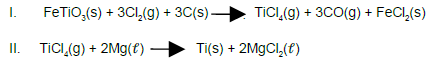
O titânio, metal leve utilizado na construção de equipamentos industriais, aeronaves e na confecção de implantes dentários e de cerdas de escovas de dente, é resistente a corrosão e a temperaturas altas.
O processo de produção do titânio, a partir da ilmenita representada pela fórmula molecular FeTiO3 , inclui, resumidamente, as equações químicas I e II, em destaque.
A partir dessas considerações e das equações químicas, que representam o processo de produção do titânio, é correto afirmar:
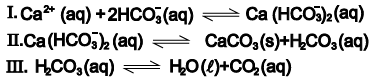
As algas zooxanthellae são também responsáveis pela intensa precipitação de carbonatos no esqueleto dos corais escleractíneos principais formadores dos recifes. Em pH próximo a 8,5, a maior parte do CO2 (aq) disponível na água do mar se encontra na forma de íons bicarbonato, HCO3- (aq). Devido à intensa radiação solar, os corais e os invertebrados que possuem algas simbiontes — sensíveis a pequenas alterações de temperatura — capturam ativamente íons de cálcio, Ca2+(aq), que reagem com íons bicarbonato.O bicarbonato de cálcio se decompõe em carbonato de cálcio, que se precipita sob forma de esqueleto, e ácido carbônico, H2CO3 (aq), usado na fotossíntese. Trata-se de um processo bioquímico muito eficiente, porém sujeito às alterações das concentrações de CO2 (g), na atmosfera.
Uma análise do processo bioquímico de formação de esqueleto de carbonato de cálcio dos corais escleractíneos referidos no texto e de acordo com as equações químicas I, II e III, permite afirmar:
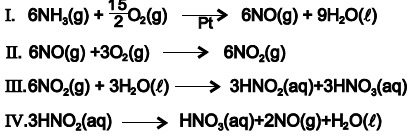
Com base nessas informações e de acordo com as equações químicas que representam o processo de fabricação do ácido nítrico, é correto afirmar:
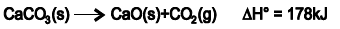
O calcário formado principalmente por carbonato de cálcio, CaCO3 (s), é um mineral importante na correção da acidez do solo, na produção de cimento e de óxido de cálcio CaO, conhecido como cal.
O Brasil utiliza cerca de um milhão de toneladas de óxido de cálcio por ano. A partir da decomposição térmica do carbonato de cálcio representada pela equação química, é correto afirmar:
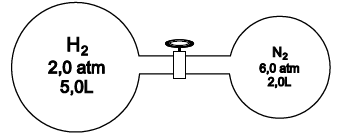
A figura representa um sistema formado por dois recipientes interligados por uma válvula fechada, a determinada temperatura, contendo, respectivamente, os gases ideais, hélio e nitrogênio, nas condições apresentadas.
A partir da abertura da válvula, a essa temperatura, é correto afirmar:
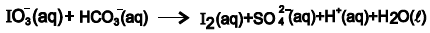
O iodato de sódio, NaIO3 , é utilizado como aditivo de sal de cozinha, NaCl, com objetivo de prevenir o bócio, uma doença provocada pela deficiência de iodo na alimentação. A equação química não balanceada representa a reação do íon iodato com o íon hidrogeno-sulfito, na determinação de iodo, I2 .
A partir do balanceamento da equação química com os menores coeficientes estequiométricos inteiros, é correto afirmar:
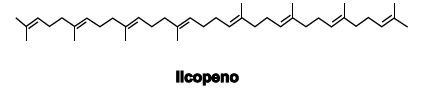
O licopeno, representado pela fórmula estrutural, é responsável pela cor vermelha dos pimentões e dos tomates. É encontrado em grandes concentrações na polpa e no extrato do tomate, sendo recomendado no combate a radicais livres produzidos por células do organismo humano. Em relação a esse pigmento vermelho, é correto afirmar:
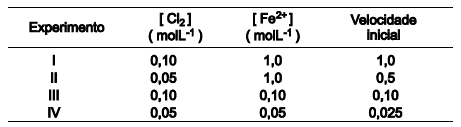
Uma análise dessas informações e dos dados da tabela permite afirmar:
Considerando-se essas informações a análise de texto e admitindo-se que a densidade da água é 1,0g/cm3 , é correto afirmar:
Considerando-se essas informações, é correto afirmar:
A partir da análise dessas informações, é correto afirmar:
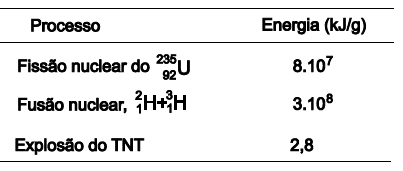
A energia liberada na reação de fusão de 1,0g de urânio 235 é muito maior que a produzida na explosão de 1,0g de TNT. Essa energia, quando controlada em um reator nuclear, pode ser utilizada nas usinas termonucleraes, na geração de energia elétrica, por meio da produção de vapor de água, que movimenta a turbina de um gerador elétrico. Embora a quantidade de energia liberada na fusão nuclear seja muito maior que a da fissão do urânio 235, e mais vantajosa para geração de energia elétrica, não foi ainda desenvolvida uma tecnologia adequada ao seu aproveitamento. A partir dessas considerações e dos dados apresentados na tabela, é correto afirmar:
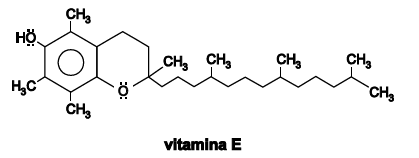
A vitamina E, representada pela fórmula estrutural, é encontrada no espinafre, na batata, na castanha, no gérmen de trigo e nos óleos vegetais. É utilizada como conservante de alimentos em razão de suas propriedades antioxidantes.
A partir das informações sobre a vitamina E, é correto afirmar:
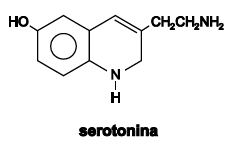
A serotonina, representada pela fórmula estrutural, é um dos neurotransmissores responsáveis pelas sensações de prazer, de bem-estar e de estar apaixonado. Hoje se sabe que essa substância não é somente produzida no cérebro, mas nos intestinos. Considerando-se essas informações, é correto afimar:
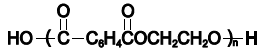
A reciclagem de garrafas de politereftalato de etileno, PET, juntando-se ao algodão, vem ganhando espaço no mercado com a produção de tecidos utilizados na confecção de bolsas e de sapatos, com objetivo de reduzir os problemas ambientais causados pelo lixo de plástico.
Um dos aspetos da transformação de garrafas PET em fibras para produção de tecidos está associado
A partir dessas considerações, é correto afirmar: