Tem-se uma solução de NH4OH 0,10 mol/L. Sabendo-se que a di...
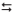 NH4(aq) + OH−
(aq) , assinale a alternativa que
apresenta a concentração do íon OH−
em mol/L e o pH da
solução nas condições dadas. Considere que para o
hidróxido de amônio Kb=1,0x10-5.
NH4(aq) + OH−
(aq) , assinale a alternativa que
apresenta a concentração do íon OH−
em mol/L e o pH da
solução nas condições dadas. Considere que para o
hidróxido de amônio Kb=1,0x10-5.Comentários
Veja os comentários dos nossos alunos
Dados:
k = 10e-5
[NH4OH] = 0,1 mol/L ou 10e-1 mol/L
[NH4] = x mol/L
[OH] = x mol/L
-
k = [produtos] / [reagentes]
k = [NH4] . [OH] / [NH4OH]
10e-5 = x . x / 10e-1
x.x = 10e-5 . 10e-1
x2 = 10e-6
x = raiz(10e-6)
x = 10e-3
-
Portanto, a concentração de OH é 10e-3 mol/L, logo o pOH é 3 e o pH é 11
Clique para visualizar este comentário
Visualize os comentários desta questão clicando no botão abaixo