Questões de Vestibular
Foram encontradas 410 questões
Resolva questões gratuitamente!
Junte-se a mais de 4 milhões de concurseiros!
Dados:
Constante de ionização (Ka) do H₂CO₃ = 4 x 10⁻⁷
Constante de ionização (Kb) do NH₃= 2 x 10⁻⁵
Constante de ionização (Kw) do H₂O = 1 x 10⁻¹⁴
Os indicadores ácido base são substâncias cuja cor se altera em uma faixa específica de pH. Atabela a seguir apresenta afaixa de viragem (mudança de cor) de alguns indicadores ácido base.
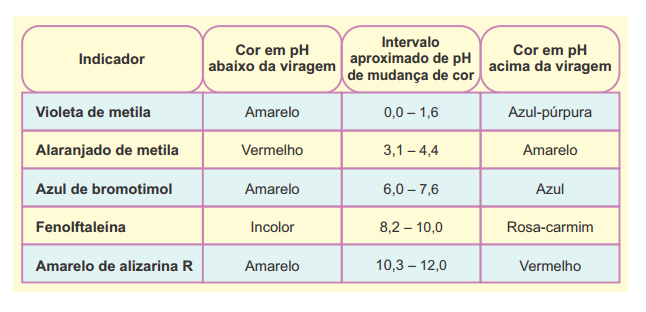
A partir da análise dessa tabela, um técnico executou um procedimento para distinguir algumas soluções.
Para diferenciar uma solução de 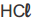 de concentração 1,0 mol.L⁻¹ de uma solução de
de concentração 1,0 mol.L⁻¹ de uma solução de 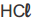 e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
e concentração 0,01 mol.L⁻¹ ele utilizou o indicador X. Para diferenciar uma solução de bicarbonato de sódio (NaHCO₃) de concentração 0,01 mol.L⁻¹ ele utilizou o indicador Y. Para diferenciar uma solução de amoníaco (NH₃) de concentração 1,0 x 10⁻³ mol.L⁻¹ de uma solução de hidróxido de sódio (NaOH) de concentração 0,1 mol.L⁻¹ ele utilizou o indicador Z.
A alternativa que apresenta os indicadores X, Y e Z adequados para cada um dos procedimentos propostos pelo técnico é
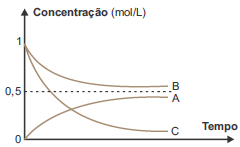
A respeito do experimento, foram feitas algumas afirmações:
I. A e B são reagentes e C é o produto da reação estudada. II. A reação química estudada é corretamente representada pela equação: B + 2 C → A III. Não houve consumo completo dos reagentes, sendo atingido o equilíbrio químico. IV. A constante de equilíbrio dessa reação, no sentido da formação de A, nas condições do experimento é menor do que 1.
Estão corretas apenas as afirmações:
Com base no texto, é possível afirmar que a água do Rio Doce
Uma solução aquosa de nitrato de prata (0,050 mol L -1 ) é usada para se determinar, por titulação, a concentração de cloreto em uma amostra aquosa. Exatos 10,00 mL da solução titulante foram requeridos para reagir com os íons Cl- presentes em 50,00 mL de amostra. Assinale a concentração, em mol L-1 , de cloreto, considerando que nenhum outro íon na solução da amostra reagiria com o titulante.
Dado: Ag+ (aq) + Cl- (aq) → AgCl(s)
