Questões do Enem
Sobre grandezas: massa, volume, mol, massa molar, constante de avogadro e estequiometria. em química
Foram encontradas 58 questões
LEE. J. D Química Inorgânica não tão concisa. São Paulo: Edgard Blucher. 1999 (adaptado).
Considerando que um forno foi alimentado com 2,5 toneladas de ferro-gusa, a massa de gás carbônico formada, em quilogramas, na produção de aço doce, é mais próxima de
Em um medicamento, a varfarina é administrada por via intravenosa na forma de solução aquosa, com concentração de 3,0 mg/mL. Um indivíduo adulto, com volume sanguíneo total de 5,0 L, será submetido a um tratamento com solução injetável desse medicamento.
Qual é o máximo volume da solução do medicamento que pode ser administrado a esse indivíduo, pela via intravenosa, de maneira que não ocorram hemorragias causadas pelo anticoagulante?
Disponível em: www.anvisa.gov.br. Acesso em: 1 ago. 2012 (adaptado).
Considerando-se o valor de 6 X 1023 mol-1 para a constante de Avogadro e a massa molar do cálcio igual a 40 g/mol, qual a quantidade mínima diária de átomos de cálcio a ser ingerida para que uma pessoa supra suas necessidades?
Pesquisadores conseguiram produzir grafita magnética por um processo inédito em forno com atmosfera controlada e em temperaturas elevadas. No forno são colocados grafita comercial em pó e óxido metálico, tal como CuO. Nessas condições, o óxido é reduzido e ocorre a oxidação da grafita, com a introdução de pequenos defeitos, dando origem à propriedade magnética do material.
VASCONCELOS, Y. Um ímã diferente. Disponível em: http://revistapesquisa.fapesp.br. Acesso em: 24 fev. 2012 (adaptado).
Considerando o processo descrito com um rendimento de 100%, 8 g de CuO produzirão uma massa de CO2 igual a
Dados: Massa molar em g/mol: C = 12; O = 16; Cu = 64
O polímero PET (tereftalato de polietileno), material presente em diversas embalagens descartáveis, pode levar centenas de anos para ser degradado e seu processo de reciclagem requer um grande aporte energético. Nesse contexto, uma técnica que visa baratear o processo foi implementada recentemente. Trata-se do aquecimento de uma mistura de plásticos em um reator, a 700 °C e 34 atm, que promove a quebra das ligações químicas entre átomos de hidrogênio e carbono na cadeia do polímero, produzindo gás hidrogênio e compostos de carbono que podem ser transformados em microesferas para serem usadas em tintas, lubrificantes, pneus, dentre outros produtos.
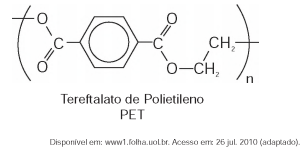
Considerando o processo de reciclagem do PET, para tratar 1 000 g desse polímero, com rendimento de 100%, o volume de gás hidrogênio liberado, nas condições apresentadas, encontra-se no intervalo entre
Dados: Constante dos gases R = 0,082 L atm/mol K;
Massa molar do monômero do PET = 192 g/mol; Equação
de estado dos gases ideais: PV = nRT

Com base nas informações do texto, a quantidade máxima recomendada de aspartame, em mol, que uma pessoa de 70 kg de massa corporal pode ingerir por dia é mais próxima de
Dado: massa molar do aspartame = 294 g/mol

Considerando um processo de combustão completa de um gás de cozinha composto exclusivamente por butano (C4H10), a mínima quantidade desse gás que um japonês deve deixar de queimar para atender à meta diária, apenas com esse gesto, é de
Dados: CO2 (44 g/mol); C4H10 (58 g/mol)
Três amostras de minérios de ferro de regiões distintas foram analisadas e os resultados, com valores aproximados, estão na tabela:
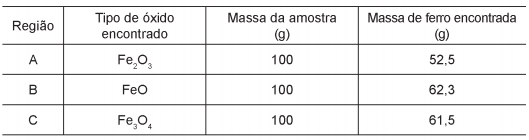
Considerando que as impurezas são inertes aos compostos envolvidos, as reações de redução do minério de ferro com carvão, de formas simplificadas, são:
2 Fe2O3 + 3 C → 4 Fe + 3 CO2
2 FeO + C → 2 Fe + CO2
Fe3O4 + 2 C → 3 Fe + 2 CO2
Dados: Massas molares (g/mol) C = 12; O = 16; Fe = 56; FeO = 72; Fe2O3 = 160; Fe3O4 = 232.
Os minérios que apresentam, respectivamente, a maior pureza e o menor consumo de carvão por tonelada de ferro
produzido são os das regiões:
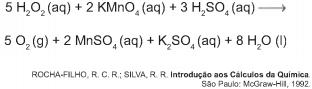
De acordo com a estequiometria da reação descrita, a quantidade de permanganato de potássio necessária para reagir completamente com 20,0 mL de uma solução 0,1 mol/L de peróxido de hidrogênio é igual a

Um lote contendo 5 amostras de solda estanho- chumbo foi analisado por um técnico, por meio da determinação de sua composição percentual em massa, cujos resultados estão mostrados no quadro a seguir.
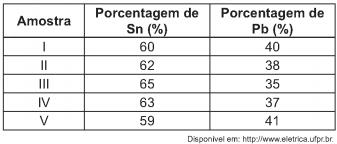
Com base no texto e na análise realizada pelo técnico, as amostras que atendem às normas internacionais são
Fator de emissão de CO2 = Massa de CO2 emitida/ Quantidade de material
O termo “quantidade de material” pode ser, por exemplo, a massa de material produzido em uma indústria ou a quantidade de gasolina consumida por um carro em um determinado período.
No caso da produção do cimento, o primeiro passo é a obtenção do óxido de cálcio, a partir do aquecimento do calcário a altas temperaturas, de acordo com a reação:
CaCO3(s) → CaO(s) + CO2(g)
Uma vez processada essa reação, outros compostos inorgânicos são adicionados ao óxido de cálcio, tendo o cimento formado 62% de CaO em sua composição.
Dados: Massas molares em g/mol — CO2 = 44; CaCO3 = 100; CaO = 56.
TREPTOW, R. S. Journal of Chemical Education. v. 87 n° 2, fev. 2010 (adaptado).
Considerando as informações apresentadas no texto, qual é, aproximadamente, o fator de emissão de CO2 quando 1 tonelada de cimento for produzida, levando-se em consideração apenas a etapa de obtenção do óxido de cálcio?
PbS04 Na2CO3→PbCo3 + Na2SO4
Dados: Massas Molares em g/mol Pb = 207; S = 32; Na = 23; 0 = 1 6 ;C = 12
ARAÚJO, R. V. V.; TINDADE, R. B. E.; SOARES, P. S. M. Reciclagem de chumbo de bateria auto motiva: estudo de caso.
Disponível em: http://www.iqsc.usp.br. Acesso em: 17 abr. 2010 (adaptado)
Segundo as condições do processo apresentado para a obtenção de carbonato de chumbo (II) por meio da lixiviação por carbonato de sódio e considerando uma massa de pasta residual de uma bateria de 6 kg, qual quantidade aproximada, em quilogramas, de PbC03 é obtida?
o limite entre a vida aeróbica e anaeróbica. Nesse contexto, um parâmetro chamado Demanda Bioquímica de Oxigênio (DBO) foi definido para medir a quantidade de matéria orgânica presente em um sistema hídrico. A DBO corresponde à massa de 0 2 em miligramas necessária para realizar a oxidação total do carbono orgânico em um litro de água.
BAIRD, C. Quimica Ambiental. Ed. Bookmam, 2005 (adaptado).
Dados: Massas molares em g/mol: C = 12;H = 1 ;0 = 1 6 .
Suponha que 10 mg de açúcar (fórmula mínima CH2O e massa molar igual a 30 g/mol) são dissolvidos em um litro de água; em quanto a DBO será aumentada?



