Questões do Enem
Sobre termoquímica: energia calorífica, calor de reação, entalpia, equações e lei de hess. em química
Foram encontradas 17 questões
O quadro apresenta as entalpias de combustão de alguns combustíveis nas condições padrão.
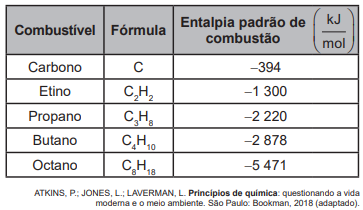
Visando a redução do impacto ambiental, qual dos combustíveis listados libera maior quantidade de energia com menor produção de CO2 ?
Grande parte da atual frota brasileira de veículos de passeio tem tecnologia capaz de identificar e processar tanto o etanol quanto a gasolina. Quando queimados, no interior do motor, esses combustíveis são transformados em produtos gasosos, num processo com variação de entalpia menor que zero (∆H < 0). Esse processo necessita de uma energia de ativação, a qual é fornecida por uma centelha elétrica.
O gráfico que esboça a variação da energia potencial no
progresso da reação é representado por:
2 H2 (g) + O2 (g) → 2 H2O (g)
Um cilindro contém 1 kg de hidrogênio e todo esse gás foi queimado. Nessa reação, são rompidas e formadas ligações químicas que envolvem as energias listadas no quadro.
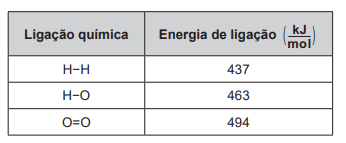
Massas molares ( g/mol ): H2 = 2; O2 = 32; H2O = 18.
Qual é a variação da entalpia, em quilojoule, da reação de combustão do hidrogênio contido no cilindro?
O valor correspondente à energia consumida para que o motorista de um carro econômico, movido a álcool, percorra 400 km na condição de máximo rendimento é mais próximo de
Glicólise é um processo que ocorre nas células, convertendo glicose em piruvato. Durante a prática de exercícios físicos que demandam grande quantidade de esforço, a glicose é completamente oxidada na presença de O2. Entretanto, em alguns casos, as células musculares podem sofrer um déficit de O2 e a glicose ser convertida em duas moléculas de ácido lático. As equações termoquímicas para a combustão da glicose e do ácido lático são, respectivamente, mostradas a seguir:
C6H12O6 (s) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (l) ∆cH = −2 800 kJ
CH3CH(OH)COOH (s) + 3 O2 (g) → 3 CO2 (g) + 3 H2O (l) ∆cH = −1 344 kJ
O processo anaeróbico é menos vantajoso energeticamente porque
Por meio de reações químicas que envolvem carboidratos, lipídeos e proteínas, nossas células obtêm energia e produzem gás carbônico e água. A oxidação da glicose no organismo humano libera energia, conforme ilustra a equação química, sendo que aproximadamente 40% dela é disponibilizada para atividade muscular.
C6H12O6( s ) + 6 O2 (g) → 6 CO2 (g) + 6 H2O (I) ΔcH= -2 800 kJ
Considere as massas molares (em g mol-1): H = 1; C=12; O = 16.
LIMA, L. M.; FRAGA, C.A. M.; BARREIRO, E. J. Química na saúde. São Paulo: Sociedade Brasileira de Química, 2010 (adaptado).
Na oxidação de 1,0 grama de glicose, a energia obtida
para atividade muscular, em quilojoule, é mais próxima de
O carro flex é uma realidade no Brasil. Estes veículos estão equipados com motor que tem a capacidade de funcionar com mais de um tipo de combustível. No entanto, as pessoas que têm esse tipo de veículo, na hora do abastecimento, têm sempre a dúvida: álcool ou gasolina? Para avaliar o consumo desses combustíveis, realizou-se um percurso com um veículo flex, consumindo 40 litros de gasolina e no percurso de volta utilizou-se etanol. Foi considerado o mesmo consumo de energia tanto no percurso de ida quanto no de volta.
O quadro resume alguns dados aproximados sobre esses combustíveis.
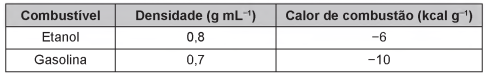
O volume de etanol combustível, em litro, consumido no percurso de volta é mais próximo de
O ferro é encontrado na natureza na forma de seus minérios, tais como a hematita (α-Fe2 O3), a magnetita (Fe3O4) e a wustita (FeO). Na siderurgia, o ferro-gusa é obtido pela fusão de minérios de ferro em altos fornos em condições adequadas. Uma das etapas nesse processo é a formação de monóxido de carbono. O CO (gasoso) é utilizado para reduzir o FeO (sólido), conforme a equação química:
FeO (s) + CO (g) → Fe (s) + CO2(g)
Considere as seguintes equações termoquímicas:
Fe2O3 (s) + 3 CO (g) → 2 Fe (s) + 3 CO2 (g) ΔrH = -25 kJ/mol de Fe2O3
= -25 kJ/mol de Fe2O3
3 FeO (s) + CO2 (g) → Fe3O4 (s) + CO (g) ΔrH = -36 kJ/mol de CO2
= -36 kJ/mol de CO2
2 Fe3O4 (s) + CO2 (g) → 3 Fe2O3 (s) + CO (g) ΔrH = +47 kJ/mol de CO2
= +47 kJ/mol de CO2
O valor mais próximo de ΔrH , em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
, em kJ/mol de FeO, para a reação indicada do FeO (sólido) com o CO (gasoso) é
A obtenção de energia por meio da fissão nuclear do 235U é muito superior quando comparada à combustão da gasolina. O calor liberado na fissão do 235U é 8 x 1010 J/g e na combustão da gasolina é 5 x 104 J/g.
A massa de gasolina necessária para obter a mesma energia na fissão de 1 kg de 235U é da ordem de
Para comparar a eficiência de diferentes combustíveis, costuma-se determinar a quantidade de calor liberada na combustão por mol ou grama de combustível. O quadro mostra o valor de energia liberada na combustão completa de alguns combustíveis.
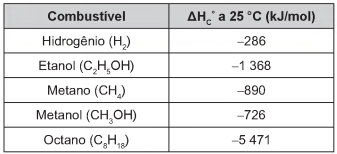
As massas molares dos elementos H, C e O são iguais a 1 g/mol, 12 g/mol e 16 g/mol, respectivamente.
ATKINS, P Princípios de química. Porto Alegre: Bookman, 2007 (adaptado).
Qual combustível apresenta maior liberação de energia
por grama?
Atualmente, soldados em campo, seja em treinamento ou em combate, podem aquecer suas refeições, prontas e embaladas em bolsas plásticas, utilizando aquecedores químicos, sem precisar fazer fogo. Dentro dessas bolsas existe magnésio metálico em pó e, quando o soldado quer aquecer a comida, ele coloca água dentro da bolsa, promovendo a reação descrita pela equação química:
Mg (s) + 2 H2O (I) → Mg(OH)2 (s) + H2 (g) + 350 kJ
O aquecimento dentro da bolsa ocorre por causa da
O benzeno, um importante solvente para a indústria química, é obtido industrialmente pela destilação do petróleo. Contudo, também pode ser sintetizado pela trimerização do acetileno catalisada por ferro metálico sob altas temperaturas, conforme a equação química:
3 C2H2 (g) → C6H6 (l)
A energia envolvida nesse processo pode ser calculada indiretamente pela variação de entalpia das reações de combustão das substâncias participantes, nas mesmas condições experimentais:
I. C2H2 (g) + 5/2 O2 (g) → 2 CO2 (g) + H2O (l) ΔHc° = -310 kcal/mol
II. C6H6 (l) + 15/2 O2 (g) → 6 CO2 (g) + 3 H2O (l) ΔHc° = -780 kcal/mol
A variação de entalpia do processo de trimerização, em kcal, para a formação de um mol de benzeno é mais próxima de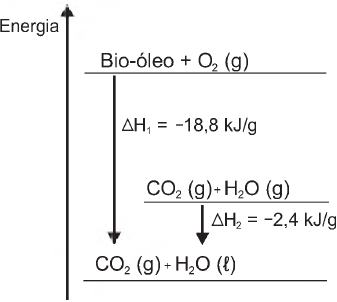
A variação de entalpia, em kJ, para a queima de 5 g desse bio-óleo resultando em CO2 (gasoso) e H2O (gasoso) é:
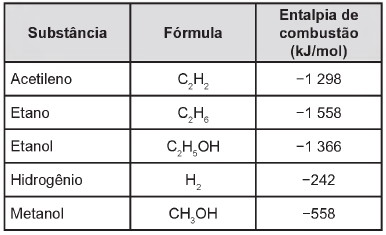
Levando-se em conta somente o aspecto energético, a substância mais eficiente para a obtenção de energia, na combustão de 1 kg de combustível, é o
A usina termelétrica a carvão é um dos tipos de unidades geradoras de energia elétrica no Brasil. Essas usinas transformam a energia contida no combustível (carvão mineral) em energia elétrica.
Em que sequência ocorrem os processos para realizar essa transformação?
Observe atentamente a charge.

Além do risco de acidentes, como o referenciado na
charge, o principal problema enfrentado pelos países
que dominam a tecnologia associada às usinas
termonucleares é

Neste contexto, qual dos combustíveis, quando queimado completamente, libera mais dióxido de carbono no ambiente pela mesma quantidade de energia produzida?