Questões Militares de Farmácia
Foram encontradas 2.256 questões
Nas negociações de contratos de fornecimento de doses das vacinas de COVID-19 entre o Ministério da Saúde e os laboratórios produtores, muito se ouviu falar na mídia sobre a responsabilização das partes envolvidas quanto aos danos aos pacientes submetidos à vacinação. Essa responsabilização acontece na fase de farmacovigilância, que contempla as atividades relacionadas à detecção, avaliação, compreensão e prevenção de eventos adversos ou quaisquer outros problemas relacionados a medicamentos. A legislação da Anvisa que regulamenta as atividades de farmacovigilância é a RCD n° 406, de 22 de julho de 2020.
São exigências regulatórias determinadas pela RDC n° 406/2020, exceto
Emulsão é uma dispersão de dois líquidos imiscíveis (ou parcialmente miscíveis), sendo um distribuído uniformemente na forma de gotículas finas (a fase dispersa) por meio do outro (a fase contínua). Os líquidos imiscíveis são, por convenção, descritos como “óleo” e “água”, já que, invariavelmente, um dos líquidos é apolar (um óleo, cera ou lipídio) e o outro é polar (água ou uma solução aquosa). Como as emulsões são termodinamicamente instáveis, retornam para fases contínuas separadas de óleo e água, a não ser que sejam cineticamente estabilizadas pela adição de agentes emulsificantes.
São exemplos de agentes emulsificantes típicos utilizados como excipientes de formulações farmacêuticas do tipo óleo/água de emulsões tópicas, exceto
A Instrução Normativa nº 43, de 21 de agosto de 2019, dispõe sobre as Boas Práticas de Fabricação (BPF) complementares aos sistemas computadorizados utilizados na fabricação de medicamentos. Um sistema computadorizado é um conjunto de software e componentes de hardware que, juntos, cumprem certas funcionalidades.
São determinações para manutenção das BPF relacionadas aos sistemas computadorizados, exceto
De acordo com a Resolução da Diretoria Colegiada da Agência Nacional de Vigilância Sanitária - RDC N° 200, de 26 de dezembro de 2017, que dispõe sobre os critérios para a concessão e a renovação do registro de medicamentos com princípios ativos sintéticos e semissintéticos, classificados como novos, genéricos e similares, e dá outras providências, a documentação técnica de qualidade para registro de um medicamento deve incluir relatórios técnicos contendo informações sobre o produto, o processo e os insumos, dentre outros requisitos, considerando que a embalagem primária, aquela que mantém contato direto com o medicamento, é um importante insumo de um produto farmacêutico.
A sequência que apresenta corretamente os requisitos exigidos na documentação técnica relacionada à embalagem primária para registro de medicamentos está indicada em
De acordo com o Guia de Qualidade Quality Risk Management do International Conference on Harmonization (ICH-Q9) e com os requisitos de boas práticas de fabricação, o gerenciamento de risco da qualidade é um processo sistemático de avaliação, controle, comunicação e revisão de riscos para a qualidade do medicamento. Para uso na indústria farmacêutica, dois princípios básicos devem ser considerados: ser baseado em conhecimentos científicos e utilizar de documentação e nível de esforço proporcionais ao nível de risco. Nesse sentido, diversas ferramentas de análise de risco de complexidades distintas são comumente utilizadas, devendo ser aplicadas em conformidade com o nível do risco avaliado.
São exemplos de ferramentas de análise de risco, exceto
O gráfico mostra uma carta controle hipotética do teste de determinação de peso, obtida durante a análise de Controle Estatístico de Processo, referente ao período de um ano de coleta de dados na revisão de qualidade de um produto (Revisão Periódica de Produto) na forma farmacêutica comprimido.
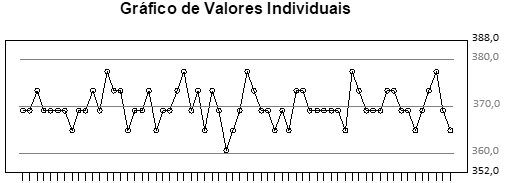
Fonte: Arquivo da Banca Elaboradora.
Pela análise do gráfico, é correto afirmar que
A validação de limpeza na indústria farmacêutica é parte integrante das Boas Práticas de Fabricação (BPF) e deve ser realizada para confirmar a eficácia de qualquer procedimento de limpeza para todos os equipamentos com contato direto com os produtos.
Sobre a validação de limpeza é correto afirmar que
A Instrução Normativa n°47/2019 é uma norma complementar às Boas Práticas de Fabricação (BPF) definidas pela RDC n° 301/2019 e dispõe das atividades de qualificação e validação. A norma aborda diferentes tipos de validação de processo e abordagens que buscam a realização do produto ao longo do seu ciclo de vida, ou seja, envolve todas as fases da vida útil do produto, desde o desenvolvimento inicial até a descontinuação do uso.
Sobre validação de processo e ciclo de vida do produto, é correto afirmar que
Informe se é verdadeiro (V) ou falso (F) o que se afirma acerca do processo de scale-up de produtos na indústria farmacêutica.
( ) Uma das possibilidades de falha durante o scale-up é o dimensionamento incorreto do tamanho do lote de escala industrial.
( ) Durante o scale-up podem ser utilizados parâmetros de processo nos equipamentos industriais diferentes daqueles utilizados nos equipamentos laboratoriais.
( ) A comparação entre o princípio de funcionamento dos equipamentos em escala laboratorial e industrial não é fator relevante no planejamento do scale-up.
( ) Alterações na formulação e mudanças na ordem de adição dos insumos podem levar a falhas no scale-up.
A sequência correta é
O processo de compressão de comprimidos acontece mediante a aplicação de uma força externa sobre as partículas de um pó ou de outro sistema particulado sólido, resultando na transferência de força através dos pontos de contato interparticulares, promovendo assim uma deformação no material. Esta deformação pode apresentar comportamento do tipo elástico, plástico ou destrutivo.
Sobre o processo de compressão, é correto afirmar que
Informe se é verdadeiro (V) ou falso (F) o que se afirma a seguir sobre o estudo de equivalência farmacêutica, os ensaios de desempenho e os critérios de bioisenção para a forma farmacêutica spray nasal.
( ) Não se aplica a realização do estudo de perfil de dissolução comparativo. ( ) O ensaio de desempenho específico pode incluir a demonstração da comparabilidade do manuseio dos dispositivos.
( ) A análise de distribuição do tamanho de partículas/gotículas por difração a laser não precisa ser realizada no ensaio de desempenho se comprovado que cada acionamento do dispositivo do medicamento teste entrega a mesma quantidade de fármaco do acionamento do dispositivo do medicamento referência.
( ) O número de atuações por dispositivo e o padrão de spray são testes obrigatórios no estudo de equivalência farmacêutica.
( ) O estudo de bioequivalência pode ser dispensado desde que o medicamento teste contenha o mesmo fármaco, na mesma concentração e com a mesma composição qualitativa de excipientes na formulação, em relação ao medicamento referência.
A sequência correta é
São tipos de água para uso farmacêutico a água purificada (AP), a água para injetáveis (API) e a água ultrapurificada (AUP).
A respeito de sua produção, parâmetros críticos e controle de qualidade, é correto afirmar que
A maioria dos compostos orgânicos podem se cristalizar em duas ou mais estruturas sólidas tridimensionais, capacidade que recebe o nome de polimorfismo. Na indústria farmacêutica, o polimorfismo é considerado um fenômeno de grande importância, pois pode alterar propriedades como biodisponibilidade, processabilidade e estabilidade do insumo farmacêutico ativo.
São propriedades que podem diferir entre distintas formas polimórficas de um mesmo insumo farmacêutico ativo, exceto as da sequência indicada em
O teste de dissolução possibilita determinar a quantidade de substância ativa dissolvida no meio de dissolução quando o produto é submetido à ação de aparelhagem específica, sob condições experimentais descritas. Na avaliação dos resultados dos testes de dissolução, a quantidade de substância ativa (fármaco) dissolvida é determinada pelo termo “Q”, sendo o valor de Q especificado na monografia individual do produto. Quando se trata de produtos de liberação prolongada, aplicam-se os termos Q1 e Q2, que correspondem à quantidade mínima e máxima de fármaco dissolvido em cada intervalo de tempo especificado na monografia, expressos como porcentagem da quantidade declarada.
A respeito do método de avaliação da dissolução (liberação), dos estágios de avaliação da liberação (L) e dos critérios de aceitação do teste de dissolução (liberação) para formas farmacêuticas de liberação prolongada, como o Adalat Oros®, é correto afirmar que
As formas farmacêuticas sólidas orais de liberação modificada são concebidas para modularem a liberação do fármaco, retardando ou prolongando a sua dissolução. Um exemplo de medicamento que possui liberação modificada é o Adalat Oros®, comprimidos de liberação prolongada indicados para tratamento da hipertensão arterial e doença arterial coronária. São comprimidos que possuem um sistema baseado na pressão osmótica (bomba osmótica), no qual o fármaco está contido em uma matriz revestida por uma membrana semipermeável, contendo um orifício. A membrana permite a penetração da água no comprimido, permitindo o “bombeamento” do fármaco através do orifício, o que possibilita sua liberação constante, sem interferência do pH do meio. A taxa na qual a água é capaz de passar por meio da membrana e o quão rapidamente a solução (ou suspensão) de fármaco é capaz de passar para fora pelo orifício controlam a taxa de liberação de fármaco. Esse sistema de liberação requer excipientes farmacêuticos específicos.
São exemplos de excipientes que podem ser usados para a constituição de bombas osmóticas, utilizadas em formas farmacêuticas orais de liberação prolongada, exceto
As operações de fabricação de medicamentos estéreis executadas em áreas limpas são divididas em duas categorias: primeiro aquelas em que o produto passa por esterilização terminal e segundo, aquelas que são conduzidas assepticamente em algumas ou todas as etapas.
Com relação à construção das salas limpas para a fabricação asséptica, é correto afirmar que
A fabricação de medicamentos estéreis, como as vacinas, deve ser realizada em áreas limpas, que são classificadas de acordo com as características exigidas do ambiente em quatro graus de limpeza: grau A, grau B, grau C e grau D. Essas áreas devem ser submetidas a monitoramento ambiental, sendo verificados os níveis de contaminantes particulados e microbiológicos e sendo obrigatório o atendimento a limites de contaminação pré-estabelecidos para as condições “em repouso” e “em operação”.
Quanto ao monitoramento ambiental de áreas limpas, é correto afirmar que
De acordo com a Farmacopeia Brasileira 6ª edição – Volume 1, os produtos farmacêuticos não devem conter quantidades de solventes residuais superiores àquelas que permitam os dados de segurança. Neste sentido, os solventes podem ser classificados por avaliação de risco como “solventes que devem ser evitados” (Classe 1); “solventes que devem ser limitados” (Classe 2) e “solventes com baixo potencial tóxico” (Classe 3).
A sequência que apresenta apenas solventes residuais de Classe 2 está corretamente indicada em