Questões Militares Sobre química
Foram encontradas 2.062 questões
Os principais efeitos colaterais observados na administração desse medicamento são: sonolência, cansaço excessivo, dores musculares, dores estomacais, gastrites, câimbras musculares, dores de cabeça, irritabilidade, pensamento confuso, alterações nos batimentos cardíacos, sudorese, diarreia, náuseas, vômitos, alterações na mucosa vaginal, alterações na secreção biliar. E sua interação com outras substâncias pode causar alterações dos efeitos ou intensificar as reações adversas, como é o caso das interações com anti-histamínicos, anti-inflamatórios e bebidas alcoólicas, que podem, inclusive, levar a lesões no fígado e no sistema gastrointestinal. Já a administração concomitante com antiácidos pode diminuir a eficácia do medicamento e, por isso, também não é recomendada.
Adaptado. Disponível em: Eritromicina: para que serve, BULA, posologia, efeitos colaterais, como usar (guiamedicobrasileiro. com.br). Acesso: 06 de janeiro de 2022.
Observe a imagem a seguir.
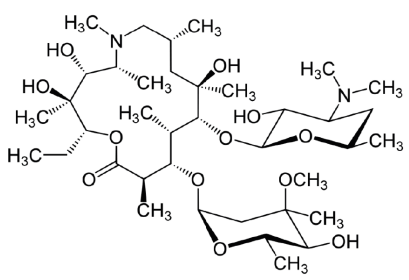
Imagem. Eritromicina. Fórmula estrutural. Disponível em: 1200px-Azithromycin_structure.svg.png (1200×817) (wikimedia.org). Acesso: 06 de janeiro de 2022
De acordo com a imagem acima, contendo a fórmula estrutural da Eritromicina, assinale a alternativa que apresenta as funções químicas orgânicas nela presentes.
Adaptado. Disponível em: Petróleo: o que é e para que serve? - eCycle. Acesso: 06 de janeiro de 2022
Observe as imagens a seguir.

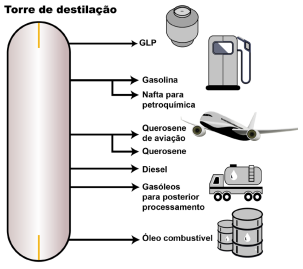
Imagem(Adaptado) . Torre de fracionamento do petróleo. Disponível em: https://combustivel-energia.blogspot.com/2012/10/ petroleo-e-derivados.html. Acesso: 06 de janeiro de 2022.
Utilizando os dados contidos na questão e seus conhecimentos sobre a obtenção de combustíveis a partir do petróleo, assinale a alternativa correta que apresenta o processo de separação de misturas mais relevante durante a obtenção destes combustíveis e a propriedade física adequada utilizada para esta separação, respectivamente.
Adaptado. Disponível em: Cobre: Ocorrência, obtenção industrial, propriedades e utilização - UOL Educação. Acesso: 05 de janeiro de 2022.
Um dos minérios mais utilizados na obtenção do cobre metálico é a calcosita, que pode ser representada pela fórmula Cu2 S. Um método de retirada do enxofre do minério é o processo de ustulação (por meio de aquecimento em presença de ar seco, rico em gás oxigênio). Observe a equação não balanceada a seguir, que representa o processo citado anteriormente:
Cu2S + O2 → Cu + SO2
Após o balanceamento da equação anterior, assinale a alternativa que apresenta qual é a massa aproximada (em gramas) de cobre metálico que pode ser obtida a partir de 2,0 Kg de Cu2S, com 60% de pureza e gás oxigênio suficiente. (Dados: massas atômicas - Cu = 63,5; S = 32).
Al0 + 3Ag+ → Al3+ + 3Ag0
A partir desta observação da pilha acima representada pela equação, assinale a alternativa correta.
Tabela. Dados de amostras de acordo com suas concentrações hidrogeniônicas e hidroxiliônicas.
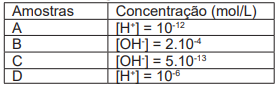
Use: log2= 0,3; log5= 0,7 (aproximações)
De acordo com os dados presentes na tabela, assinale a alternativa correta, quanto à acidez, à neutralidade ou à basicidade das amostras A, B, C e D.
Observe a figura a seguir:
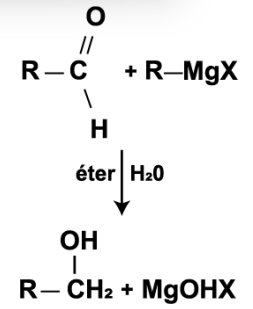
Figura. Reação genérica entre um composto de Grignard com um aldeído, na presença de éter e água.
Considerando R, uma cadeia com 3 carbonos e X, o cloro (Cl), assinale a alternativa que apresenta quais seriam os nomes do álcool e do sal básico formados, respectivamente.
Disponível em: Biogás: a próxima fronteira da energia renovável (bndes.gov.br). Acesso: 05 de janeiro de 2022.
Durante os processos de tratamento de resíduos, em Estações de Tratamento de Efluentes (ETE), uma das etapas consiste na utilização de um microrganismo que auxilia na degradação da matéria orgânica com mais eficiência e rapidez, liberando o biogás que é geralmente utilizado na produção de eletricidade, que é utilizada na própria ETE, tornado o processo mais sustentável. Assinale a alternativa correta que apresenta a etapa na qual é introduzido um microrganismo, durante o tratamento de efluentes.
De acordo com os dados do enunciado, os volumes, em mL, de etanol e de água existentes em 15L da solução de etanol usada para a higienização, são, respectivamente
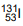 radioativo foi empregado pela primeira vez em 1941 no Massachusetts General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Dependendo da dose de iodo radioativo administrada, pode ser necessária a internação do
paciente, geralmente em um quarto especial para impedir que outras pessoas sejam expostas à radiação. O isótopo
radioativo foi empregado pela primeira vez em 1941 no Massachusetts General Hospital, quando Hertz e Roberts trataram pacientes com hipertireoidismo. Dependendo da dose de iodo radioativo administrada, pode ser necessária a internação do
paciente, geralmente em um quarto especial para impedir que outras pessoas sejam expostas à radiação. O isótopo 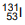 possui
possui O elemento químico mais eletronegativo, localizado no grupo 17 e no segundo período da Tabela Periódica, tende a formar I de carga II para ficar mais estável e, nessa configuração, sua última camada eletrônica possui III elétrons.
Esse elemento se associa ao hidrogênio, formando uma substância que pode ser usada para criar situações de destruição em massa, uma vez que produz efeitos sistêmicos decorrentes da hipocalcemia, hipomagnesemia e hiperpotassemia, além da possível ocorrência de coagulopatia e arritmias cardíacas fatais. (Disponível em: https://www.msdmanuals.com/pt-br. Adaptado)
Completam, correta e respectivamente, as lacunas I, II e III:
2 C4H10 (g) + 13 O2(g) → 8 CO2(g) + 10 H2O(g)
Nessa reação, a variação do número de oxidação do átomo de oxigênio é
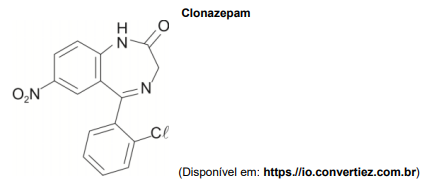
A função orgânica presente no clonazepam que inclui o grupo carbonila é

Cu2+(aq) + 2
Massa molar: Na=23 g/mol; H=1 g/mol; O=16 g/mol.
Massa molar: O=16 g/mol; H=1 g/mol; C=12 g/mol.