Questões Militares de Química
Foram encontradas 2.077 questões

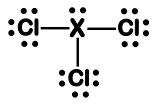
I. A molécula adota uma estrutura trigonal plana, com ângulo de ligação Cl-X-Cl maior ou igual a 120°.
II. A molécula adota uma estrutura tetraédrica, com ângulo de ligação Cl-X-Cl maior que 109,5°.
III. O átomo “X” pode ser o nitrogênio, preservando a geometria molecular. IV. O átomo “X” pode ser o boro, preservando a geometria molecular.
Assinale a opção que contém a(s) afirmação(ões) CORRETA(S):


I. Um processo termodinâmico é definido pelo estado final e estado inicial do sistema.
II. ∆T é sempre nula em um processo isotérmico.
III. A troca de calor envolvida em um processo isotérmico deve ser nula (q = 0).
IV. Todo processo em que ∆T = 0 é um processo isotérmico.
V. ∆T = 0 para todo processo em sistema isolado.
Assinale a opção que contém as afirmações ERRADAS:

I. A reação do metil benzeno com o ácido sulfúrico fumegante é mais rápida comparada à reação do benzeno nas mesmas condições experimentais.
II. A reação de nitração do metil benzeno produz preferencialmente compostos orto- e parasubstituídos.
III. A nitração do benzeno é mais rápida do que a nitração do nitrobenzeno, a qual requer uma maior concentração de ácido nítrico e uma temperatura maior.
IV. O único produto resultante da reação de nitração do 1-hidroxi-4-metil-benzeno é o 1-hidroxi-2-nitro4-metil-benzeno.
V. A reação de nitração do ácido benzoico produz preferencialmente o composto meta-substituído.
Assinale a opção que contém as afirmações CORRETAS:

2A + B ⇆ C + D + Q
em que A e B são reagentes, C e D os produtos e Q o calor liberado. Avalie as seguintes suposições sobre o efeito das modificações de um parâmetro da reação, mantendo os outros constantes.
I. Conduzir a reação a 600 °C gera uma fração maior de C e D.
II. Conduzir a reação a 600 °C faz com que o equilíbrio seja alcançado em menos de 60 min.
III. Conduzir a reação a uma pressão de 100 atm gera uma fração menor de C e D.
IV. Remover C e D do meio reacional após o equilíbrio e então retomar a reação permitem obter uma fração total maior de C e D.
Escolha a opção que lista a(s) afirmação(ões) CORRETA(S).


Experimentos foram realizados, bombardeando cada material com uma quantidade de partículas a e registrando o número de partículas coletadas em cada detector, conforme a tabela abaixo.
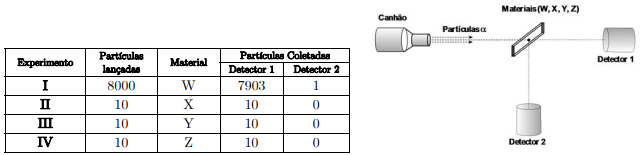
A partir dessas informações, assinale a alternativa que apresenta a conclusão CORRETA sobre as observações feitas nos experimentos.

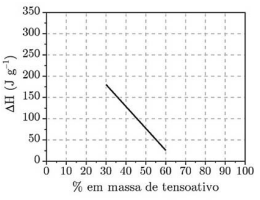
I. O ∆H refere-se à transição de fase do tensoativo.
II. O calor latente de fusão do tensoativo puro é -180 J.g-1.
III. Até 35% em massa de água pode se apresentar na forma associada à substância e não funde. IV. O ∆H é proporcional à quantidade de água não associada ao tensoativo.
Com base no gráfico e nas informações do enunciado, assinale a opção que indica a(s) afirmação(ões) CORRETA(S).

I. A concentração de oxigênio na atmosfera está diminuindo significativamente no último século, devido à queima de combustíveis fósseis e à redução da vegetação terrestre e marinha.
II. Os maiores contribuintes para a produção de oxigênio e sua liberação na atmosfera terrestre são florestas densas, pastagens, ervas e arbustos.
III. O oxigênio está envolvido, em algum grau, em todos os outros ciclos biogeoquímicos.
IV. Águas doces frias são as maiores fontes de oxigênio livre na Terra.
Assinale a alternativa que apresentam as afirmações ERRADAS.

I. Os aminoácidos são pequenas moléculas com propriedades bioquímicas únicas determinadas por seus grupos funcionais.
II. Os aminoácidos em pH fisiológico (~7,4) apresentam os grupamentos amina protonados, enquanto os grupos carboxílicos assumem sua forma de base conjugada.
III. Os aminoácidos podem se polimerizar por meio de reações de adição para formar as ligações peptídicas (CO-NH).
IV. As variações no comprimento e sequência de aminoácidos de polipeptídios são características que contribuem para a diversidade na forma e nas funções biológicas das proteínas.
V. Todos os aminoácidos obtidos de polipeptídios são opticamente ativos, isto é, eles desviam o plano da luz polarizada.
Assinale a alternativa que apresenta as afirmações CORRETAS.



I. Água e metanol.
II. Acetona e dissulfeto de carbono.
III. Acetona e clorofórmio.
IV. n-hexano e n-heptano. V. Metanol e etanol.
Assinale a alternativa que apresenta os pares de substâncias que formam soluções consideradas ideais.
Disponível em: <http://g1.globo.com/sp/campinas-regiao/noticia/2012/05/carreta- com-produto-quimico-tomba-em-curva-de-rodovia-em-paulinia-sp.html>. Acesso em: 9 de ago. 2021 (adaptado).
O cumeno, cuja nomenclatura é isopropilbenzeno, pode ser explorado industrialmente para a produção de fenol e propanona pelo processo de oxidação descrito na equação química a seguir:
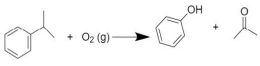
Considerando que todo o produto na carreta seja 100% puro, o qual seria completamente consumido na produção de 7,5 toneladas de fenol, qual é o valor aproximado previsto do rendimento dessa reação?
As semirreações de redução a seguir descrevem como pode ocorrer esse processo reacional:
Fe2+(aq) + 2e- → Fe(s) E0 = - 0,44 V
O2 (g) + 4H+ (aq) + 4e- → 2H2O (l) E0 = + 1,23 V
Em uma suposta pilha formada pelas duas semirreações, qual substância atuaria como agente redutor?
A estrutura química da Zidovudina é representada a seguir:
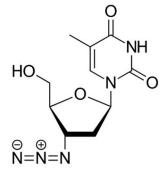
Se considerados apenas os grupos oxigenados na estrutura do AZT, estão presentes no medicamento Zidovudina os grupos funcionais
O quadro a seguir apresenta alguns combustíveis com suas respectivas entalpias molares de combustão:
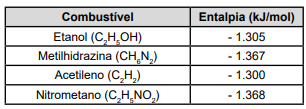
A partir desses dados, qual combustível pode liberar mais energia se, isoladamente, 100 g de cada substância for completamente queimada?
Sabe-se que a soda cáustica é o nome usual do hidróxido de sódio (NaOH), que é comercializada no estado sólido no qual, em alguns produtos disponíveis, o grau de pureza é cerca de 90% em massa. No laboratório, quando se deseja neutralizar 10 g de soda cáustica, são necessários 100 mililitros de solução de ácido clorídrico (HCl).
Com base nessas informações, qual é a concentração, em mol/L, do ácido clorídrico necessária para neutralizar completamente a soda cáustica?
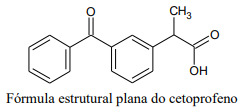
Nessa molécula, pode-se observar as seguintes funções orgânicas:
I- Moléculas de Metano Líquido (CH4)
II- Moléculas de água e metanol (H2O e CH3OH)
III- Moléculas de Bromo e água (Br2 e H2O)
Assinale a alterativa que descreve corretamente o tipo de interação possível entre pares de moléculas, com base na estrutura e nas características de cada espécie.