Questões Militares Sobre química
Foram encontradas 2.062 questões
Número atômico dos elementos: O=8; F=9; Na=11.
2. HCOONa + H2SO4 → 2HCOOH + Na2SO4
Uma solução aquosa foi preparada a partir da dissolução de 6,8 g de metanoato de sódio em 100 ml de água. Essa solução preparada reagiu com uma solução de ácido sulfúrico com centração de 0,2 mol/L para formação do ácido fórmico. Sabendo que a quantidade de solução de ácido sulfúrico foi a quantidade estequiométrica para completar a reação de síntese, a concentração da solução de metanoato de sódio preparada e a quantidade de solução de ácido sulfúrico adicionada, respectivamente, foram:
Massa molar: Na=23 g/mol; C=12 g/mol; O=12 g/mol; O=16 g/mol; H=1 g/mol
A tabela a seguir apresenta algumas informações a respeito de alguns ácidos graxos.
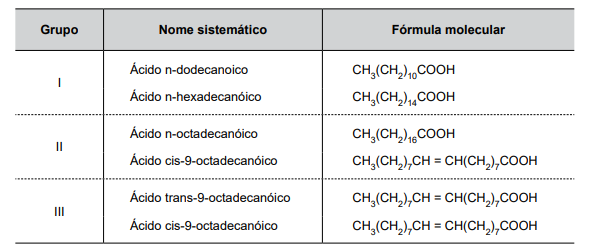
Dentro de cada grupo, I, II e III, os ácidos graxos que apresentam os pontos de fusão mais altos são, correta e respectivamente:
Na figura, é apresentada a fórmula de Haworth para a forma hemiacetálica cíclica de um monossacarídeo.
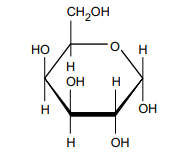
Trata-se de uma __________ e a conformação do átomo de carbono anomérico é _________ . Em relação à sua estrutura de cadeia aberta, a ciclização ocorreu entre os átomos de carbono de números _____________ .
Assinale a alternativa que preenche, correta e respectivamente, as lacunas do texto.
Uma mistura de fenilamina, a anilina, C6 H7N, e fenilmetanol, o álcool benzílico, C7H8O, foi submetida a um procedimento para separação, conforme representado no esquema da figura a seguir.
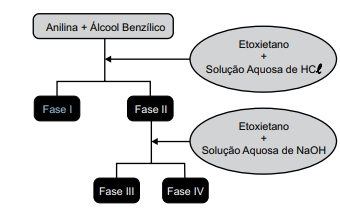
O álcool benzílico e um sal de amina estão presentes,
preponderante e respectivamente, nas fases
O composto orgânico oxigenado, X, reage, em condições adequadas, de acordo com as equações de reação representadas a seguir.
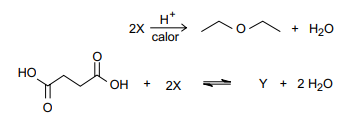
O composto Y tem a seguinte fórmula molecular:
Foi adicionada a uma bomba calorimétrica selada, com volume invariável a 25 ºC, uma mistura gasosa de um hidrocarboneto saturado e oxigênio, com pressão total P1 , em proporção estequiométrica para reação de combustão completa.
Após acionada a ignição, a mistura gasosa reagiu completamente. Considerando que o volume do líquido formado na reação é desprezível em relação ao volume total do compartimento e que a pressão P2 no interior da bomba calorimétrica após a reação 25 ºC é igual a 0,5 x P1 , a fórmula molecular do hidrocarboneto empregado no experimento é:
Foram misturados sob agitação Ag2S sólido e uma solução de saturada de H2S (0,1 mol/L) em H+ (0,15 mol/L).
Considerem-se as constantes de equilíbrio a 25 ºC:
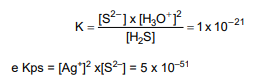
Nessa temperatura, ao se atingir o equilíbrio, a concentração de íons Ag+ na solução será:
Um procedimento para obtenção de estanho metálico foi realizado a partir do óxido de estanho (IV), em um compartimento selado que, após ser evacuado, foi preenchido com gás hidrogênio. Ao ser atingido o equilíbrio químico a 900 K, a atmosfera gasosa no interior do compartimento era composta por 45% gás hidrogênio, em volume.
A constante de equilíbrio, Kp, para essa reação a 900 K é igual a, aproximadamente,
Os dados do estudo cinético de uma reação representada por
2 A → 2B + 3C
possibilitaram construção de uma curva de rapidez da reação, representada na figura a seguir.
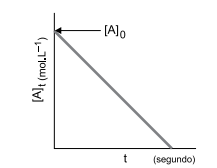
(P. Atkins; L. Jones; Princípios de Química: questionando a vida
moderna e o meio ambiente. 5a
ed. Trad. Ricardo Bicca de Alencastro.
Porto Alegre: Bookman, 2012. Adaptado)
A ordem dessa reação e as unidades de sua constante
de velocidade são: