Questões Militares Sobre química
Foram encontradas 2.062 questões
Em cinco béqueres foram adicionados 50 mL de uma solução de referência, que consiste de uma solução aquosa saturada em cloreto de prata, contendo corpo de fundo, a 25 °C e 1 atm. A cada béquer, foram adicionados 50 mL de uma solução aquosa diluída diferente, dentre as seguintes:
I. Solução de cloreto de sódio a 25 °C.
II. Solução de Glicose a 25 °C.
III. Solução de Iodeto de sódio a 25 °C.
IV. Solução de Nitrato de prata a 25 °C.
V. Solução de Sacarose a 50 °C.
Considere que o corpo de fundo permanece em contato com as soluções após rápida homogeneização das
misturas aquosas e que não ocorre formação de óxido de prata sólido. Nestas condições, assinale a opção que
indica a(s) solução(ões), dentre as acima relacionadas, que altera(m) a constante de equilíbrio da solução de
referência.
Considere o seguinte mecanismo de reação genérica:
A4++ B2+ → A3+ + B3+ (etapa lenta)
A4+ + B3+ → A3+ + B4+ (etapa rápida)
C+ + B4+ → C3+ + B2+ (etapa rápida)
Com relação a este mecanismo, assinale a opção ERRADA.
Considere os seguintes líquidos, todos a 25 °C:
I. Cu(NO3)2 (aq)
II. CS2(l )
III. CH3CO2H(aq)
IV. CH3(CH2)16 CH2OH(l )
V. HCl (aq)
VI. C6H6( l )
Assinale a opção que indica o(s) líquido(s) solúvel(eis) em tetracloreto de carbono.
A seguinte reação não-balanceada e incompleta ocorre em meio ácido:
(Cr2O7 )-2 + (C2 O4)-2 → Cr3+ + CO2
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
Uma barra de ferro e um fio de platina, conectados eletricamente a um voltímetro de alta
impedância, são parcialmente imersos em uma mistura de soluções aquosas de FeSO4 (1,0 mol L–1) e HCl isenta de oxigênio. Um fluxo de gás hidrogênio é mantido constante sobre a parte imersa da superfície da
platina, com pressão nominal (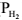 ) de 1,0 atm, e a força eletromotriz medida a 25 °C é igual a 0,292 V.
) de 1,0 atm, e a força eletromotriz medida a 25 °C é igual a 0,292 V.
Considerando-se que ambos os metais são quimicamente puros e que a platina é o polo positivo do elemento galvânico formado, assinale a opção CORRETA que apresenta o valor calculado do pH desse meio aquoso.
Dados: 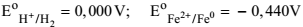
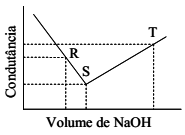
Uma solução aquosa de HCl 0,1 mol L–1 foi titulada com uma solução aquosa de NaOH 0,1 mol L–1. A figura ao lado apresenta a curva de titulação obtida em relação à condutância da solução de HCl em função do volume de NaOH adicionado.
Com base nas informações apresentadas nesta figura, assinale a opção ERRADA.
Historicamente, a teoria atômica recebeu várias contribuições de cientistas.
Assinale a opção que apresenta, na ordem cronológica CORRETA, os nomes de cientistas que são apontados como autores de modelos atômicos.
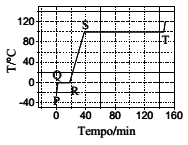
A figura ao lado apresenta a curva de aquecimento de 100 g de uma substância pura genérica no estado sólido. Sabe-se que calor é fornecido a uma velocidade constante de 500 cal min–1. Admite-se que não há perda de calor para o meio ambiente, que a pressão é de 1 atm durante toda a transformação e que a substância sólida apresenta apenas uma fase cristalina. Considere que sejam feitas as seguintes afirmações em relação aos estágios de aquecimento descritos na figura:
I. No segmento PQ ocorre aumento da energia cinética das moléculas.
II. No segmento QR ocorre aumento da energia potencial.
III. O segmento QR é menor que o segmento ST porque o calor de fusão da substância é menor que o seu calor de vaporização.
IV. O segmento RS tem inclinação menor que o segmento PQ porque o calor específico do sólido é maior que o calor específico do líquido.
Das afirmações acima, está(ão) ERRADA(S):
Considere a versão tridimensional da Tabela Periódica sugerida pelo químico Paul Giguère. Nesta representação, a Tabela Periódica se assemelha a um catavento onde os blocos s, p, d, f são faces duplas formadoras das pás do catavento e onde o eixo de sustentação está fixado ao longo do bloco s.
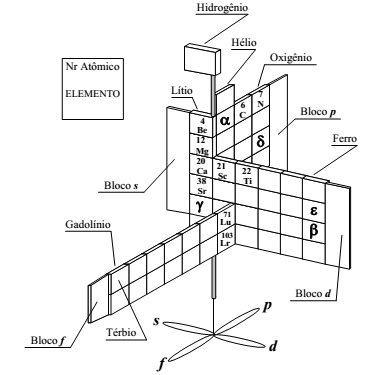
Em relação à tabela acima, assinale a alternativa correta.
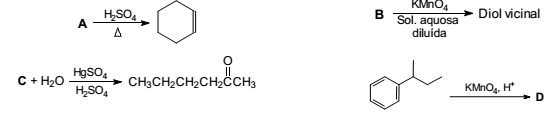
Dadas as reações acima, escolha, dentre as opções abaixo, a que corresponde,
respectivamente, às funções orgânicas das substâncias A, B, C e D.
Assinale a alternativa correta.
CrI3 + Cl2 + NaOH → NaIO4 + Na2CrO4 + NaCl + H2O
Assinale a alternativa que indica a soma dos menores coeficientes inteiros capazes de balancear a equação química acima:
Em um recipiente fechado queima-se propano com 80% da quantidade estequiométrica de ar. Admitindo que não haja hidrocarbonetos após a combustão, que todos os produtos da reação estejam na fase gasosa e que a composição volumétrica do ar seja de uma parte de O2 para quatro partes de N2, calcule a porcentagem molar de CO2 no recipiente após a combustão (considere comportamento ideal para os gases).
Considere as seguintes possibilidades para a estrutura da molécula de trifluoreto de cloro (ClF3):
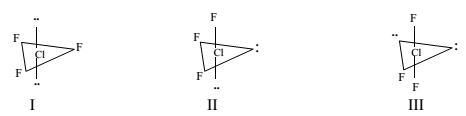
Assinale a alternativa correta.
