Questões Militares Sobre química
Foram encontradas 2.062 questões

Neste caso, podemos afirmar que
I - 1 mol de hidróxido de NaOH neutraliza totalmente 1 mol de HCl. II - Trata-se de uma reação de uma base forte com um ácido forte. III - O ácido clorídrico ficará quase que completamente dissociado.
Entre as alternativas certas, encontra (m)-se
Sobre esse assunto, é correto afirmar que:
Bicarbonato 100,0
Cálcio 22,0
Sódio 8,98
Nitrato 4,11
Sulfato 6,00
Magnésio 3,26
Potássio 2,70
Cloreto 0,73
Fluoreto 0,34
Sabe-se que a massa molar do íon sulfato (SO42-) é de 96 g/mol. A quantidade de mols de íons sulfato contida em 16 L dessa água mineral é:
Cl2(g) + OH1-(aq) → Cl1-(aq) + ClO31-(aq) + H2O(l)
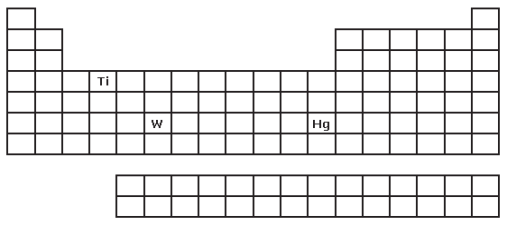
I) É freqüentemente usado em lâmpadas incandescentes, tem elevado ponto de fusão e número atômico igual 74.
II) É líquido nas condições ambiente (25º C e 1 atm) e utilizado em barômetros, em lâmpadas especiais e em odontologia.
III) Possui número atômico 22 e está na família 4 da Tabela Periódica. Algumas de suas utilizações podem ser assim exemplificadas: aplicação de próteses em joelhos e quadris; colocação de pinos para fixação entre a mandíbula e a prótese dentária.
Os metais descritos em I, II e III são, respectivamente:
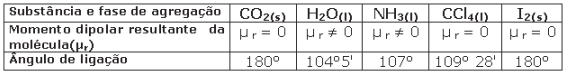
A alternativa que relaciona corretamente a molécula da substância, a polaridade dessa molécula, a forma geométrica dessa molécula e o tipo de força intermolecular dessa substância, nessa ordem, é:
O carbonato de sódio (Na2CO3) empregado na fabricação de vidro é preparado a partir do carbonato de cálcio (CaCO3) e cloreto de sódio (NaCl), segundo a equação balanceada:
CaCO3 + 2 NaCl → Na2CO3 + CaCl2
Partindo-se de 1250 g de carbonato de cálcio (com grau de pureza de 80%) e 650 g de cloreto de sódio (com grau de pureza de 90%), a massa de carbonato de sódio (Na2CO3) obtida dessa reação, admitindo-se um rendimento da reação de 80%, será de:
Dados:
Massas atômicas: C=12u; O=16u; Na=23u; Cl=35,5u; Ca=40u
A tabela abaixo indica valores das velocidades da reação (v) em três experimentos e as correspondentes concentrações em mol/L dos reagentes X e Y em idênticas condições.

O processo químico é representado pela equação abaixo, na qual a, b e c representam seus coeficientes.
a X + b y → c Z
A equação da velocidade desse processo é:
H2O(l) → H2O(v) ΔH= + 44kj/mol
A quantidade de calor necessária para provocar a vaporização de 900 mL de água líquida nesse processo é:
Dados:
Densidade da água = 1,0 g/ml
Massas atômicas: H=1 u; 0 = 16 u
pós a dissolução, as soluções contidas nas provetas 1 e 2 apresentam, respectivamente, caráter
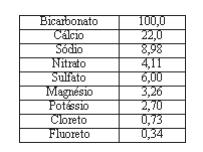
Sabe-se que a massa molar do íon sulfato (SO4 2- ) é de 96 g/mol. A quantidade de mols de íons sulfato contida em 16 L dessa água mineral é:
F > Cl > Br > I > S
Fila de Reatividade dos Ametais
Analisando a Fila de Reatividade acima, a equação que representa a reação química que ocorre espontaneamente é:
Be(g) + E1 → Be(g)+ + e-
Mg(g) + E2 → Mg(g)+ + e-
Sr(g) + E3 → Sr(g)+ + e-
Sabendo-se que:
E1 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Be;
E2 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Mg;
E3 representa o valor da primeira energia de ionização (1ª E.I.) do átomo de Sr.
Pode-se afirmar que, ocorridas as transformações, a relação entre os valores E1, E2 e E3 será:
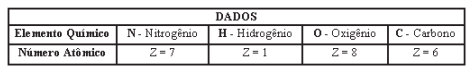
O luminol (C8H7O3N3) é um reagente de quimioluminiscência utilizado pela polícia para detectar vestígios de sangue.
Em relação aos elementos químicos C, H, O e N que compõem o luminol, pode-se afirmar que