Questões Militares de Química
Foram encontradas 2.077 questões
Marque a alternativa que apresenta corretamente a nomenclatura dos compostos citados, de acordo com a sequência mencionada no texto:
Diferentes marcas de telefones celulares buscam ganhar novos clientes, anunciando que a bateria de seus aparelhos é mais eficiente que a dos concorrentes, por manterem o telefone celular ligado por mais tempo. Quando descarregada, a bateria do celular é conectada a uma rede elétrica para que sua carga seja restabelecida.
Esse processo é um exemplo de:
No livro de Robson Fernandes de Farias,
Introdução à química forense, publicado pela editora
Átomo, de Campinas, na 2ª edição, datada de 2008,
na página 71, é dito que:
“A técnica mais utilizada [para a identificação de digitais] consiste na aplicação de uma fina camada de pó sobre o local onde, acredita-se, possa haver impressões digitais. Uma vez que impressões tenham sido assim reveladas, segue-se a etapa do decalque. Tal técnica baseia-se na aderência de um determinado pó sobre os diversos compostos químicos que compõem a impressão. Ligações de hidrogênio e forças de Van der Walls, são, essencialmente, as responsáveis por esta interação”.
Considere as assertivas a seguir:
I – A agregação da fina camada de pó sobre a impressão digital é devida às interações de dipolo elétrico entre as moléculas de água e as partículas do pó.
II – A agregação da fina camada de pó sobre a impressão digital é devida à formação da ligação iônica entre o pó e a água contida na impressão digital.
III – A técnica de análise da impressão digital (papiloscopia), assim como o teste de DNA, diferencia até gêmeos idênticos (univitelinos).
Assinale a alternativa correta:
Sobre o incidente do meteoro russo, assinale a alternativa correta:
Sobre a fumaça que anuncia a escolha do papa, assinale a alternativa correta:
Considerando que o saco plástico e o ar em seu interior formam o sistema observado e que o ar comporta-se como um gás ideal, o aluno descreveu as seguintes conclusões: I – Antes de atingir o volume máximo do saco plástico, a variação da energia interna do sistema é nula. II – O trabalho realizado pelo sistema é igual a zero. III – Trata-se de um sistema adiabático. IV – Devido ao aumento do volume do saco plástico, deduz-se que a massa de ar no interior do saco também aumentou.
Julgue se as conclusões do aluno são verdadeiras (V) ou falsas (F) e assinale a alternativa correta:
O composto mais comum de cálcio é o carbonato de cálcio, que ocorre naturalmente na forma de calcário. O calcário é decomposto por aquecimento em óxido de cálcio e dióxido de carbono. Por sua vez, o óxido de cálcio reage exotermicamente com a água, formando o hidróxido de cálcio, conhecido como cal apagado.
Assinale a alternativa que apresenta corretamente as fórmulas químicas dos compostos citados no texto: carbonato de cálcio, óxido de cálcio, dióxido de carbono e hidróxido de cálcio:
Com relação aos metais Pb, Ba e Sb: I – O raio atômico do Pb é maior que o do Ba e Sb. II – O Ba é mais eletronegativo que o Pb e menos que o Sb. III – O potencial de ionização aumenta na sequência Ba, Pb e Sb. IV – O Pb é mais denso que o Sb e o Ba.
A afirmativa correta é:
Devido ao aspecto dourado do fungo que a produz, a clortetraciclina é conhecida também como aureomicina, um antibiótico pertencente à classe das tetraciclinas. A estrutura química é apresentada a seguir:
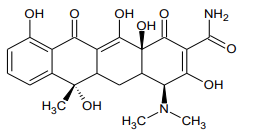
As funções orgânicas presentes na molécula são:
É conhecido que as enzimas são substâncias com propriedades altamente específicas de reação no seu sítio ativo e que sem elas várias reações metabólicas ocorreriam muito lentamente ou até mesmo deixariam de ocorrer, prejudicando sobremaneira o funcionamento normal dos organismos vivos.
Em relação à atuação das enzimas, assinale a alternativa correta.
Os alcanos são hidrocarbonetos também conhecidos como parafinas e muitos deles são derivados do petróleo; já as aminas são outra classe de compostos orgânicos e estão presentes de forma muito acentuada em seres vivos animais e vegetais, tanto vivos quanto em decomposição.
Desta forma, as fórmulas moleculares do 6- Etil 3-Metil 5-n-Propil Nonano e da Dimetil Fenil Amina são respectivamente:
O Número de Oxidação (Nox) pode ser definido como o número que mede a carga real ou a carga aparente de uma espécie química, sendo que um mesmo elemento químico pode assumir valores distintos de Nox, dependendo da substância em que esteja presente. Nesse sentido, o íon nitrato (NO-3) em alguns vegetais pode se transformar em gás nitrogênio (N2), alterando o valor do Nox do átomo de nitrogênio.
Neste processo de transformação, a variação do Nox do átomo de nitrogênio será de:
Dadas as reações químicas A e B abaixo, assinale a alternativa correta que corresponde às suas respectivas classificações.
Reação A: 2H2O + 2Na → 2NaOH + H2
Reação B: 2H2 + O2 → 2H2O
Os valores de Z (N° Atômico), A (N° de Massa), p+ (Prótons), e- (Elétrons) e n° (Nêutrons) do íon Potássio (K) carregado positivamente, na forma catiônica, e com carga elétrica igual a +1, são respectivamente:
Dados: N° estado fundamental o Potássio (K) possui N° Atômico = 19 e N° de Massa = 39.
Em processos industriais, a dureza elevada da água pode ser prejudicial, pois há tendência à incrustação de sais nas caldeiras, principalmente quando a água é aquecida. O aquecimento da água converte todo bicarbonato presente em carbonato pela eliminação de dióxido de carbono.
Ca(HCO3 )2(aq) → Xs + CO2(g) + H2O
A letra X representa qual sal?
O etanol, utilizado como combustível em carros flex, é produzido pelo processo de fermentação, do caldo de cana, “garapa”, onde leveduras transformam a sacarose em álcool, segundo a reação simplificada:
C12H22O11 + H2O → 2C6H12O6
C6H12O6 → CH3CH2OH + 2CO2 ∆H = -23,5kcal
A fermentação da sacarose trata-se de um processo:
Algumas bactérias do solo, como as nitrobactérias, catalisam a oxidação do nitrogênio contido em sais de amônio (fertilizante químico) formando nitrato, o qual pode ser assimilado pelos vegetais.
2O2 + NH4+ → NO3- + 2H+ + H2O
É correto afirmar que o nitrogênio presente no
ânion nitrato apresenta um número de oxidação
(Nox) de:
Em regiões industrializadas ou em grandes cidades, que possuem tráfego intenso, ocorre o fenômeno conhecido como smog fotoquímico. É como se uma forte neblina envolvesse a cidade durante o horário de maior insolação ocasionando desconforto visual.
O smog fotoquímico é resultado das reações de NO, radiação solar e NO2 com Compostos Orgânicos Voláteis, resultando na formação de aldeídos, nitrocompostos, aerossóis e oxidantes totais.
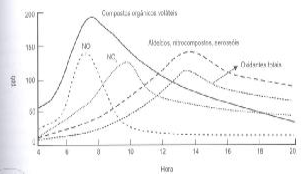
Figura 1 Variação da composição de gases atmosféricos relacionados com o smog fotoquímico ao longo do dia. (Fonte: Introdução à química ambiental. ROCHA, Julio Cesar; COSTA, André H.,CARDOSO; Arnaldo A. 2. ed. Porto Alegre: Bookman, 2009. p. 111).
Com relação à formação do smog fotoquímico,
é incorreto afirmar.
Nestes últimos anos, os alunos da EsPCEx têm realizado uma prática no laboratório de química envolvendo eletrólise com eletrodos inertes de grafite. Eles seguem um procedimento experimental conforme a descrição:
- Num béquer de capacidade 100 mL (cuba eletrolítica) coloque cerca de 50 mL de solução aquosa de sulfato de zinco (ZnSO4) de concentração 1 mol·L-1. Tome como eletrodos duas barras finas de grafite. Ligue-as com auxílio de fios a uma fonte externa de eletricidade (bateria) com corrente de 2 Ampères. Esta fonte tem capacidade para efetuar perfeitamente esse processo de eletrólise. Uma das barras deve ser ligada ao polo negativo da fonte e a outra barra ao polo positivo da fonte. Mergulhe os eletrodos na solução durante 32 minutos e 10 segundos e observe.
Considere o arranjo eletrolítico (a 25 ºC e 1 atm), conforme visto na figura a seguir:
Dados: 1 Faraday (F) = 96500 Coulomb (C) / mol de elétrons
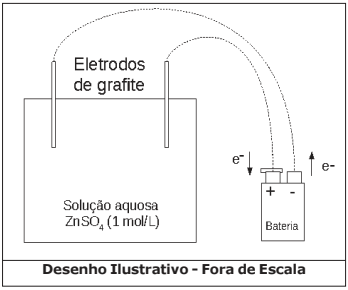
Acerca do experimento e os conceitos químicos envolvidos são feitas as seguintes afirmativas:
I – Na superfície da barra de grafite ligada como cátodo da eletrólise ocorre a eletrodeposição do zinco metálico.
II – A semirreação de oxidação que ocorre no ânodo da eletrólise é Zn (s) → Zn2+ (aq) + 2 e- .
III – Durante o processo a barra de grafite ligada ao polo positivo da bateria se oxida.
IV – No ânodo da eletrólise ocorre uma reação de oxidação da hidroxila com formação do gás oxigênio e água.
V – A massa de zinco metálico obtida no processo de eletrólise será de 0,83 g.
Das afirmativas feitas, estão corretas apenas