Questões Militares de Química
Foram encontradas 2.077 questões
Em condições ideais, pequenas quantidades de gás cloro podem ser geradas em laboratório pela reação do óxido de manganês (MnO2 ) com ácido clorídrico (HCl), conforme a equação química a seguir não balanceada.
HCl(aq) + MnO2 (s) → H2O(L) + MnCl2(s) + Cl2(g)
A partir dessas informações, quantas moléculas de gás cloro, aproximadamente, podem ser produzidas quando 10 g de óxido de manganês com grau de pureza de 87% são colocados para reagir completamente com excesso de ácido clorídrico?
Dado: Número de Avogadro (N) = 6 x 1023
A nitroglicerina é um líquido oleoso de coloração amarela, levemente esverdeada, da classe dos explosivos, substâncias que se decompõem rapidamente, com expansão súbita de gases e grande liberação de energia. Possui massa molecular de 227g.mol-1 e sua temperatura não deve ultrapassar 30°C, nem ser exposta a choques mecânicos. A nitroglicerina é obtida através da nitração da glicerina, utilizando ácido sulfúrico como catalisador. A reação da decomposição da nitroglicerina pode ser escrita como:
4C3 H5 N3 O9(l) → 10H2O(g) + 6N2(g) + O2(g) + 12CO2(g)
Sabendo que a constante dos gases é igual a 8,314J.mol-1.K-1, a decomposição de 227g de nitroglicerina a
27°C e 1,01kPa, vai liberar cerca de quantos litros de gases?
“Quando um eletrólito é adicionado à água, independentemente se a solubilidade é alta ou baixa, ocorre a sua dissociação (liberação de íons) ou ionização (produção de íons). Porém, ao mesmo tempo, esses íons voltam a formar o eletrólito, ocorrendo um equilíbrio químico de dissolução.”
(Produto de solubilidade - Manual da Química (manualdaquimica.uol.com.br). Acesso em: 15/02/2018).
Considere os carbonatos apresentados na tabela abaixo e seus respectivos valores da constante de produto de solubilidade (Kps) a 25°C.

A partir dos dados da tabela, foram feitas as seguintes afirmações sobre as solubilidades molares.
I. Carbonato de zinco é mais solúvel do que carbonato de cádmio.
II. Carbonato de zinco é mais solúvel do que carbonato de prata.
III. Carbonato de prata é mais solúvel do que carbonato de cádmio.
É verdadeiro o que se afirma em:
Polímeros são macromoléculas constituídas pela repetição de uma pequena unidade molecular (mero) de um determinado composto químico. A reação que dá origem a um polímero é denominada reação de polimerização, em que a molécula inicial (monômero) se agrupa sucessivamente com outras, produzindo o dímero, trímero, tetrâmero e, por fim, o polímero.
Quando um polímero tem como matéria prima monômeros diferentes, ele é chamado de copolímero. Observe os pares de substância abaixo.
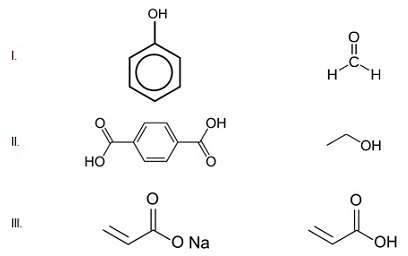
.Fonte: Arquivo da Banca Elaboradora
É possível formar copolímeros utilizando os pares
O que acontece ao se misturar cloreto de hidrogênio com propeno?
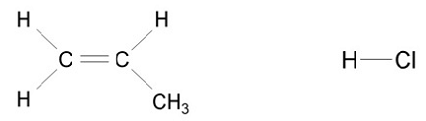
Fonte: Arquivo da Banca Elaboradora.
Analise as estruturas químicas a seguir.
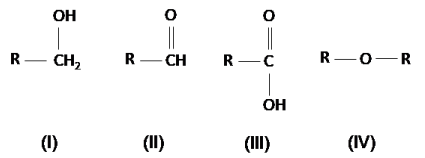
Fonte: Arquivo da Banca Elaboradora.
Segundos os grupos funcionais, podemos dizer que as substâncias I, II, III e IV, nessa ordem, são:
Em um laboratório havia 3 compostos orgânicos identificadas como I, II e III. Sob determinadas condições, observou-se que:
• As substâncias I e II reagem formando uma amida.
• As substâncias II e III reagem formando um éster.
• A substância III, caso mantida em um meio oxidativo e ácido, pode se transformar em II.
As substâncias I, II e III são, nessa ordem,
A seguir, são apresentadas algumas semi-reações de redução e seus respectivos potenciais-padrão.
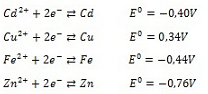
FONTE: ATKINS, P.; PAULA, J. Atkins Físico Química. 7 ed. Rio de Janeiro: LTC, 2003. v. 1. p. 336.
A partir dessas semi-reações, pode-se afirmar que
Com relação às ligações químicas (iônica ou covalente), foram feitas as proposições listadas a seguir.
I. A carga de um átomo é uma característica importante na definição do tipo de ligação, uma vez que quanto maior a carga de um átomo, maior a chance de ele formar uma estrutura iônica.
II. O tamanho de um átomo é uma característica importante na definição do tipo de ligação, uma vez que é mais fácil distribuir a nuvem eletrônica ao redor de átomos com tamanhos semelhantes.
III. Quando um par de elétrons de uma ligação é atraído simultaneamente por dois núcleos atômicos temse uma ligação covalente.
IV. Quando dois átomos possuem baixa energia de ionização, a ligação entre eles será iônica.
Está correto apenas o que se afirma em:
Com relação à química, coloque verdadeiro (V) ou (F) nas afirmativas abaixo, a seguir, a opção correta.
( ) Compostos moleculares são formados por meio de ligações metálicas.
( ) Uma substância formada pela ligação entre um metal e um ametal é iônica.
( ) Na tabela periódica, elementos presentes na coluna 17 tendem a receber elétrons, enquanto que os presentes na coluna 1 tendem a doar elétrons.
( ) A tabela periódica atual foi organizada baseada no número atômico dos elementos.
( ) Os gases nobres são elementos que reagem facilmente com qualquer outro elemento.
( ) Um elemento X- e um elemento Y2+ formarão um composto iônico X2Y.
O etanoi é um combustível obtido a partir de fontes renováveis, e cuja equação de combustão a 25°C é a seguinte:
C2H5OH(I) + 3O2(g) → 2CO2(g) + 3H2O(I) ΔH298 =-1368 kJ/mol
Sabendo-se que um volume de 8,05 litros de etanol foi queimado, a quantidade total de calor liberado, em kJ, na combustão acima é:
Dado: densidade do etanoi = 0,8 g/cm3
Considere as seguintes equações termoquímicas:
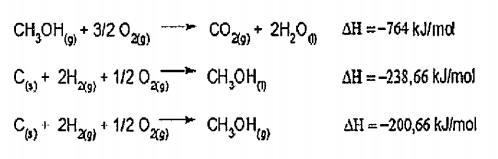
A entalpia de combustão para o metanol líquido, em
kJ/mol, é:
Analise as afirmativas abaixo acerca do preparo das substâncias para amostra e assinale a opção correta.
I- Na análise gravimétrica é necessário que o elemento desejado esteja sempre em solução.
II- Na precipitação, o reagente precipitante deve formar um precipitado quantitativamente insolúvel.
III- A filtração pode ser feita com auxílio de papel-filtro e
vácuo.
Anaiise os compostos abaixo, de 1 a 4:
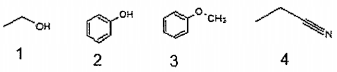
As funções orgânicas dos compostos acima são,
respectivamente:
analise a reação abaixo, com a sua respectiva equação de velocidade:
NO2(g) + CO(g) → NO(g) + CO2(g) v = kr [NO2]2
Os valores da ordem da reação acima em relação ao NO2,
ao CO, e à Ordem Global são, respectiva mente: