Questões Militares Sobre química
Foram encontradas 2.077 questões
A que temperatura a velocidade média das moléculas de um gás que está a 27°C irá duplicar?
Dado:
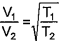
A dureza da água é um dado muito importante em diversas aplicações. As reações dos íons que geram a dureza na água com EDTA e o respectivo indicador são representados abaixo.
Ca2+ + H2Y2- ⇄ CaY2- + 2H4
Ca2+ + MgY2- ⇄ CaY2- + Mg2+
Mg2+ + HIn2- ⇄ Mgln- + H+ MgIn- + H2Y2- ⇄ MgY2- +HIn2- + H+Analise os complexos abaixo.
I- [Fe(CN)6]4-
II- [Fe(CN)6]3-
III- [Cu(NH3)4]2+
IV- [Cu(CN)4]3-
O número de coordenação em cada um dos complexos acima é, respectivamente:
O éter etílico é um composto orgânico que foi muito usado no passado como anestésico. Um dos métodos usados para sua obtenção é a desidratação intermolecular do etanol, como mostrado na reação abaixo.

Um químico deseja utilizar o mesmo método descrito
acima para sintetizar um éter assimétrico, o 2-etóxi-2-
metilpropano. Nesse caso, os álcoois de partida devem
ser
O número atômico (Z) e o número de massa (A) de um íon
+
monoatômico com carga 3 que contém 10 elétrons e 14 nêutrons são, respectivamente:
Com relação à aparelhagem comum e técnicas básicas de laboratório, assinale a opção que preenche corretamente as lacunas das sentenças abaixo.
I- Após a limpeza de uma balança analítica, o uso dessa balança deve ser,________.
II- A câmara da balança analítica deve ser mantida fechada durante a pesagem para evitar_________.
III- Para se pesar substâncias sólidas, deve-se usar preferencialmente______ .
Quando se dissolvem ácidos fortes em um solvente muito básico, como a água, ocorre a ionização completa desses ácidos e fica impossível comparar a força relativa dos mesmos. Para se evitar esse efeito, chamado de Efeito Nivelador da água, é comum dissolver ácidos fortes em um solvente menos básico, como o ácido acético, sendo possível, assim, comparar a força relativa de ácidos fortes. A esse respeito são dadas, abaixo, as equações de dissociação do HCIO4 e HCI em CH3COOH:
1) HCIO4 + CH3COOH → CH3COOH2- + CIO4- pK1 = 4,88
2) HCI + CH3COOH → CH3COOH2+ + Cl- pK2 =8,55
Com relação á Teoria de ácidos e bases de Bronsted-Lowry
e com base nas equações acima, assinale a opção
INCORRETA.