Questões Militares Sobre química
Foram encontradas 2.077 questões
Os exemplos descritos a seguir correspondem às observações realizadas para uma quantidade fixa de matéria de gás e variação de dois parâmetros. Numere as representações gráficas relacionando-as com as seguintes descrições.
1. Ao encher um balão com gás hélio ou oxigênio, o balão apresentará a mesma dimensão.
2. Ao encher um pneu de bicicleta, é necessária uma pressão maior que a utilizada em pneu de carro.
3. O cozimento de alimentos é mais rápido em maiores pressões.
4. Uma bola de basquete cheia no verão provavelmente terá aparência de mais vazia no inverno, mesmo que não tenha vazado ar.
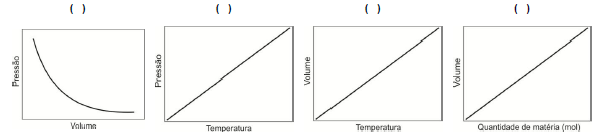
Assinale a alternativa que apresenta a sequência correta na numeração das representações gráficas.
A notícia publicada neste ano trata de um projeto de mineração de potássio. Sobre esse elemento, analise as afirmativas a seguir:
1. É um metal.
2. Soluções salinas de seus haletos costumam ser levemente alcalinas.
3. Na mineração, é extraído como substância simples de águas de lagos e rios.
4. Sua principal aplicação é em fertilizantes, onde é o terceiro macronutriente da sigla NPK.
Assinale a alternativa correta.
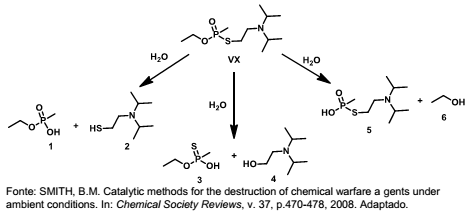
O quadro abaixo mostra as condições para detoxificação do agente VX e respectivos resultados pelos diferentes métodos.
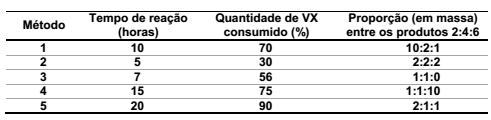
Com base nas informações fornecidas, qual método de detoxificação é mais eficiente?
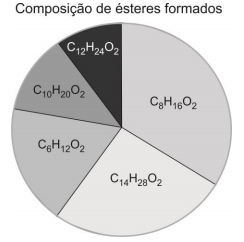
O ácido carboxílico presente em maior quantidade na amostra analisada é o:
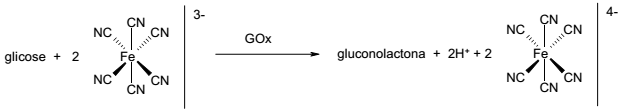
Nesse sistema de medição, faz-se reagir uma amostra contendo glicose com o íon ferricianeto ([Fe(CN)6]3- ) na presença da enzima GOx, obtendo-se como produtos gluconolactona, H+ e ferrocianeto ([Fe(CN)6]4- ). Um eletrodo de platina promove a reação de regeneração do ferricianeto, sendo que a corrente que passa por esse eletrodo é proporcional à concentração de glicose na amostra.
Com base no exposto, identifique como verdadeiras (V) ou falsas (F) as seguintes afirmativas:
( ) A enzima GOx catalisa a oxidação da glicose.
( ) No eletrodo de platina ocorre a redução do íon de ferro.
( ) A transformação de glicose em gluconolactona envolve 2 elétrons.
( ) O valor de pH do meio tende a diminuir no processo de detecção de glicose.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
2NO(g) + O2(g) →2NO2(g) , v = k[NO]2 [O2]
Para esta reação, são propostos os mecanismos reacionais I, II e III com suas etapas elementares de reação:
I. 2NO(g) ⇌ N2O2 (g) equilíbrio rápido
N2O2(g) + O2(g) → 2NO2 (g) lenta
II. NO(g) + O2 (g) ⇌ NO3(g) equilíbrio rápido
NO (g) + NO3 (g) → 2NO2 (g) lenta
III. NO(g) + ½ O2(g) → NO2(g) rápida
NO2(g) + ½ O2(g) ⇌ NO3(g) equilíbrio rápido
NO2(g) + NO3(g) ⇌ N2O4(g) equilíbrio rápido
N2O4(g) → 2NO2 (g) lenta
Dos mecanismos propostos, são consistentes com a lei de velocidade observada experimentalmente
Considere a expansão de um gás ideal inicialmente contido em um recipiente de 1 L sob pressão de 10 atm. O processo de expansão pode ser realizado de duas maneiras diferentes, ambas à temperatura constante:
I. Expansão em uma etapa, contra a pressão externa constante de 1 atm, levando o volume final do recipiente a 10 L.
II. Expansão em duas etapas: na primeira, o gás expande contra a pressão externa constante de 5 atm até atingir um volume de 2 L; na segunda etapa, o gás expande contra uma pressão constante de 1 atm atingindo o volume final de 10 L.
Com base nestas informações, assinale a proposição CORRETA.
Considere as entalpias padrão de formação dos seguintes compostos:

Sabendo que a capacidade calorífica da água, à pressão constante, vale 75,9 J·mol-1 e que sua entalpia de vaporização é igual a 40,66 kJ·mol−1, assinale a alternativa que melhor corresponda ao número de mols de metano necessários para vaporizar 1 L de água pura, cuja temperatura inicial é 25°C, ao nível do mar.
Considere uma célula eletrolítica na forma de um tubo em H, preenchido com solução aquosa de NaNO3 e tendo eletrodos inertes mergulhados em cada ramo vertical do tubo e conectados a uma fonte externa. Num determinado instante, injeta-se uma solução aquosa de CuCrO4 verde na parte central do ramo horizontal do tubo. Após algum tempo de eletrólise, observa azul e uma amarela, separadas (em escala) de acordo com o esquema da figura.
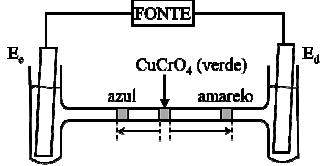
Com base nas informações do enunciado e da figura, assinale a opção ERRADA.
No estado padrão, é de 0,240 V o potencial da pilha cuja reação pode ser descrita pela seguinte equação química:
2 NO + ½ O2 + H2O → 2 HNO2.
Assinale a alternativa que apresenta o valor da energia livre padrão da reação, em kJ·mol-1.
Considere a reação descrita pela seguinte equação química:
H2(g, 1bar) + 2AgBr(s) → 2H+ (aq) + 2Br−(aq) + 2Ag(s).
Sendo X o potencial padrão (E°) da reação, o pH da solução a 25 °C quando o potencial da reação (E) for Y
será dado por
Considere os seguintes compostos químicos que se encontram no estado líquido à temperatura de 298 K e pressão ambiente de 1 bar:
I. 2-metil-pentano
II. 3-metil-pentano
III. 2,2-dimetil-butano
IV. 2,3-dimetil-butano
V. Hexano
Nestas condições, assinale a opção que apresenta a ordem decrescente da magnitude da pressão de vapor dos
respectivos compostos.