Questões Militares Sobre química
Foram encontradas 2.077 questões
O etino, também conhecido como acetileno, é um alcino muito importante na Química. Esse composto possui várias aplicações, dentre elas o uso como gás de maçarico oxiacetilênico, cuja chama azul atinge temperaturas em torno de 3000 °C.
A produção industrial do gás etino está representada, abaixo, em três etapas, conforme as equações balanceadas:

Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do
gás etino por esse método é de 100 %, então a massa de carbonato de cálcio (CaCO3(s)) necessária para produzir 5,2 g do gás etino (C2H2(g)) é
Assinale a alternativa correta:
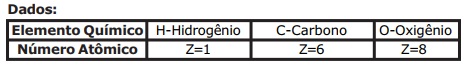
Um isótopo radioativo de Urânio-238 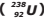 , de número atômico 92 e número de massa 238,
emite uma partícula alfa, transformando-se num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta, transformando-se num átomo M. Um
estudante analisando essas situações faz as seguintes observações:
, de número atômico 92 e número de massa 238,
emite uma partícula alfa, transformando-se num átomo X, o qual emite uma partícula beta, produzindo
um átomo Z, que por sua vez emite uma partícula beta, transformando-se num átomo M. Um
estudante analisando essas situações faz as seguintes observações:
I – os átomos X e Z são isóbaros;
II – o átomo M é isótopo do Urânio-238 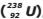
III – o átomo Z possui 143 nêutrons;
IV – o átomo X possui 90 prótons.
Das observações feitas, utilizando os dados acima, estão corretas:


A respeito dessa reação, são feitas as seguintes afirmações:
I – a reação direta trata-se de um processo exotérmico;
II – o denominador da expressão da constante de equilíbrio em termos de concentração molar (Kc) é igual a [H2O]·[C];
III – se for adicionado mais monóxido de carbono (CO(g)) ao meio reacional, o equilíbrio será deslocado para a esquerda, no sentido dos reagentes;
IV – o aumento na pressão total sobre esse sistema não provoca deslocamento de equilíbrio.
Das afirmações feitas, utilizando os dados acima, está(ão) correta(s):

II – a reação Zn2+(aq) + Cu º(s) ➞ Zn º(s) + Cu2+(aq) não é espontânea;
III – pode-se estocar, por tempo indeterminado, uma solução de nitrato de níquel II, em um recipiente revestido de zinco, sem danificá-lo, pois não haverá reação entre a solução estocada e o revestimento de zinco do recipiente;
IV – a força eletromotriz de uma pilha eletroquímica formada por chumbo e magnésio é 2,24 V;
V – uma pilha eletroquímica montada com eletrodos de cobre e prata possui a equação global: 2 Ag+ (aq) + Cuº(s) ➞ 2 Agº(s) + Cu2+ (aq) .
DADOS:
Constante de Faraday= 96500 Coulombs/mol de elétrons
Massa molar do níquel=59 g/mol
Massa molar da prata=108 g/mol

Esse conjunto de cubas em série é ligado a uma bateria
durante um certo intervalo de tempo, sendo observado
um incremento de 54 g de massa de prata em um dos
eletrodos de prata. Desse modo, o incremento da massa
de níquel em um dos eletrodos de níquel é de
Dada a seguinte equação iônica de oxidorredução da reação, usualmente utilizada em etapas de sínteses químicas, envolvendo o íon dicromato (Cr2O72-) e o ácido oxálico (H2C2O4):
Cr2O72- + H2C2O4 + H+→ + Cr3+ + CO2 + H2O
Considerando a equação acima e o balanceamento de equações químicas por oxidorredução,
a soma total dos coeficientes mínimos e inteiros obtidos das espécies envolvidas e a substância
que atua como agente redutor são, respectivamente,
1. Caráter básico.
2. Caráter anfótero.
3. Caráter neutro.
4. Caráter ácido.
( ) CO, NO, N2O.
( ) Como regra, óxidos de elementos localizados à esquerda na tabela periódica.
( ) ZnO e Al2O3.
( ) Como regra, óxidos de elementos com alta eletronegatividade.
A sequência está correta em
I. ClO–3 e NO–3 possuem geometria piramidal e trigonal respectivamente.
II. A geometria molecular do PCl5 é uma bipirâmide de base triangular.
III.H2S possui geometria linear.
Está(ão) correta(s) a(s) afirmativa(s)
( ) Após o balanceamento da equação Na2CO3(s) + FeCr2O4(s) + O2(g)→ Fe2O3(s) + Na2CrO4(s) + CO2(g), a soma dos coeficientes mínimos e inteiros das espécies químicas envolvida é 17.
( ) Na reação entre nitrato de prata e brometo de potássio dissolvidos em água, o produto que forma cristais insolúveis em água é KNO2.
( ) A queima do gás amônia produz dióxido de nitrogênio e água.
( ) Após o balanceamento da equação NH3(g) + O2(g)→ NO(g) + H2O(g), a soma de todos os coeficientes mínimos e inteiros das espécies químicas envolvidas é 19.
A sequência está correta em
( ) O carbonato de cálcio pode ser obtido da reação entre o hidróxido de cálcio e o ácido carbônico.
( ) A equação química HCl + Ca(OH)2 → Ca(OH)Cl + H2O apresenta um hidróxi‐sal como produto.
( ) Substâncias moleculares como os açúcares têm pontos de fusão mais elevados do que os de substâncias iônicas como os sais.
( ) O carbonato de lítio apresenta somente ligações iônicas.
A sequência está correta em
I. Com relação à afinidade eletrônica, a ordem correta é P > Se > Na > Cu.
II. Um metal alcalino terroso do terceiro período apresenta menor raio atômico do que um metal do quinto período e do mesmo grupo.
III. A primeira energia de ionização dos elementos decresce de cima para baixo num grupo ou família.
Está(ão) correta(s) a(s) afirmativa(s)
Associe corretamente as fórmulas aos nomes de suas respectivas substâncias e, a seguir, assinale a opção que apresenta a sequência correta.
FÓRMULAS
I - HclO
II - Cu (OH)2
III - P2O5
IV - BaSO4
V - MnO2
VI — CaC2O4
SUBSTÂNCIAS
( ) Pentóxido de difósforo.
( ) Óxido de magnésio.
( ) Sulfato de bário.
( ) Ácido hipocloroso.
( ) Hidróxido de cobre (II)
( ) Dióxido de manganês.
( ) Ácido cloroso.
( ) Oxalato de cálcio.
Uma nova mania na Europa consiste em "consumir" oxigênio puro. As embalagens são latas exclusivas com inalador em forma de copo, são fabricadas na Suíça e contêm 99,5% de oxigênio. Basta pressionar o copo inalador contra a vasilha para liberar oxigênio e respirar.
Este sistema, chamado de OXYFIT, não é um sistema de liberação contínua do gãs, mas libera o oxigênio a cada inalação.
Consumido em alguns países da América do Norte e da Europa, este produto, chamado de Opur, é vendido em embalagens de 2 litros que contêm o equivalente a 10-15 inalações, em média. Mas há também versões de 5 e de 8 litros, esta última contendo 160 gramas do gãs. Os preços variam de US$ 10 a US$ 32 a garrafa.
Considerando os dados acima e sabendo que a massa molar do oxigênio (02) é igual a 32 g/mol, assinale a opção que apresenta corretamente o número de mols de gãs oxigênio, contidos numa embalagem de 8 litros de Opur, e a densidade do conteúdo, respectivamente.
O fosfato de cálcio, Ca3(PO4)2, ê um dos compostos utilizados recentemente em pesquisas na obtenção de cimento ortopédico. A reação entre o óxido de cálcio com ácido fosfórico é uma das formas de obtenção do Ca3(PO4)2.
Assinale a opção que representa a reação química balanceada
de obtenção do fosfato de cálcio a partir de óxido de cálcio
e ácido fosfórico.
NaCℓO (aq) + H2O (l)
 HCℓO (aq) + Na+ (aq) + OH -(aq)
HCℓO (aq) + Na+ (aq) + OH -(aq)
Nesse equilíbrio, o ácido hipocloroso consegue atravessar as paredes celulares de bactérias e reagir com outras moléculas proteicas existentes dentro desses microorganismos. Desse modo, esse ácido atua como desinfetante, germicida e bactericida.
Analisando a equação do equilíbrio e a ação do ácido hipocloroso, é CORRETO afirmar que
