Questões Militares Sobre química
Foram encontradas 2.077 questões
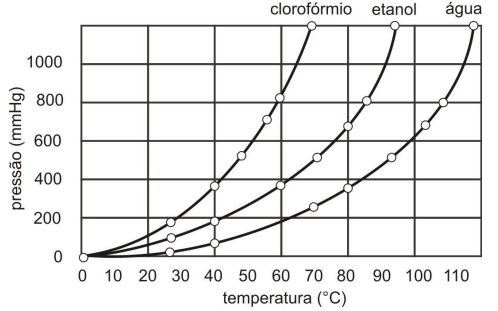
De acordo com o gráfico, é CORRETO afirmar que
Solução do frasco I: ficou rosa em fenolftaleína e amarela no metilorange.
Solução do frasco II: permaneceu incolor em fenolftaleína e vermelha no metilorange.
Solução do frasco III: permaneceu incolor em fenolftaleína e amarela no metilorange.
Sabe-se que a fenolftaleína, em pH acima de 9 apresenta coloração vermelha, enquanto que, em pH abaixo desse valor, é incolor. Sabe-se ainda que o metilorange apresenta coloração vermelha em pH abaixo de 3,5 e amarela em pH acima deste valor.
Sendo assim, os estudantes chegaram à conclusão de que os frascos I, II e III contêm, respectivamente, solução de
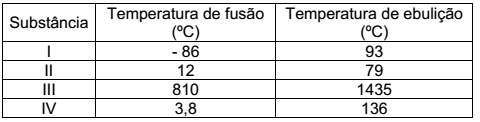
Em relação ao estado físico dessas substâncias, é CORRETO afirmar que
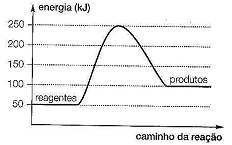
Considerando o gráfico anterior, referente ao diagrama energético de uma reação química, qual o valor da energia de ativação e o ΔH da reação respectivamente?
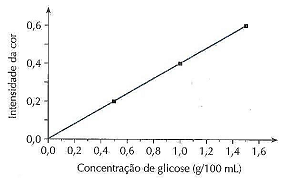
“Uma amostra de urina, submetida ao tratamento anterior, apresentou uma intensidade de cor igual a 0,4 na escala do gráfico." Qual a concentração em mols desta amostra?
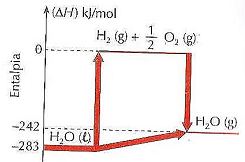
A partir do diagrama de entalpia, marque V para as afirmativas verdadeiras e F para as falsas.
( ) A quantidade de calor envolvido na decomposição de 126 g de H2O(l) → H2(g) + ½ O2(g) é 1.981 kJ/mol.
( ) H2O(l) → H2O(g) ΔH = –41 kJ/mol.
( ) H2(g) + ½ O2(g)→ H2O(g) ΔH = +242 kJ/mol.
A sequência está correta em
Fe2+(aq) + 2e– → Fe(s) E0 red = –0,44V.
Zn2+(aq) + 2e– → Zn(s) E0 red = –0,76V.
O2(g) + 4H+ (aq) + 4e– → 2H2O(l) E0 red = 1,23V.
Acerca do exposto anteriormente, analise as afirmativas a seguir.
I. A redução de O2 necessita de H+ , de forma que o aumento da concentração de H+ torna‐se a redução de O2 menos favorável.
II. O Fe2+ formado no anodo é eventualmente mais oxidado a Fe+3, que forma o óxido de ferro III hidratado.
III.O Fe2+ é mais facilmente reduzido que Zn2+.
Está(ão) correta(s) a(s) afirmativa(s)
( ) O nome 1,2‐dimetilciclopropano designa um conjunto de isômeros, os quais apresentam isomeria geométrica e óptica.
( ) No ácido láctico (ácido 2‐hidróxi‐propanóico), o carbono de número 2 é assimétrico e o composto apresenta isomeria óptica.
( ) O composto 1,2‐dicloroeteno não apresenta isomeria geométrica ou cis‐trans.
( ) O 3‐metil‐1‐propanol é isômero do 1‐butanol.
A sequência está correta em
I. CH3‐CH2‐CH3 + Cl2 → CH3‐CH2‐CH2‐Cl + HCl é uma reação de substituição.
II. 2 CH3‐CH2‐OH
 H2O+ CH3‐CH2‐O‐CH2‐CH3 é uma reação de adição.
H2O+ CH3‐CH2‐O‐CH2‐CH3 é uma reação de adição.III. CH2=CH2 + Br2 → CH2Br‐ CH2Br é uma reação de adição.
Está(ão) correta(s) a(s) afirmativa(s)
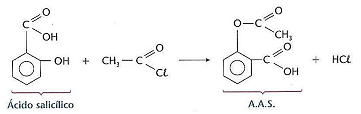
De acordo com o exposto, analise as afirmativas a seguir.
I. Na reação apresentada anteriormente o nome oficial do haleto de acila e do ácido salicílico é cloreto de etanoíla e ácido 2‐hidróxi‐benzóico.
II. Uma solução de 0,015 mol/L de aspirina com pH = 3 possui uma constante de dissociação ácida igual a 1,3 x 10–3.
III.A porcentagem de ácido ionizada na solução de 0,20 mol/L de aspirina com pH = 5 é 1,7%.
Está(ão) correta(s) a(s) afirmativa(s)
I. As partículas em um gás interagem entre si apenas quando as colisões ocorrem.
II. A energia cinética média das partículas em um gás é proporcional à temperatura absoluta do gás e depende da identidade do gás.
III. As partículas em um gás movem‐se em linhas retas, exceto quando elas colidem com outras moléculas ou com as paredes do recipiente. As colisões entre si e com as paredes do recipiente são elásticas, de tal forma que a energia cinética das partículas é conservada.
Está(ão) correta(s) a(s) afirmativa(s)
(Dados: log 1,49 = 0,17 e log 1,18 = 0,07.)
H+ (aq) + HCO– 3(aq)↔ H2CO3(aq) ↔ H2O(l) + CO2(g)
A regulagem do pH do plasma sanguíneo relaciona‐se diretamente ao transporte efetivo de O2 para os tecidos corpóreos. O oxigênio é carregado pela proteína hemoglobina encontrada nas células de glóbulos vermelhos. A hemoglobina (Hb) liga‐se reversivelmente tanto ao H+ quanto ao O2.
HbH+ + O2↔ HbO2 + H+
De acordo com as reações apresentadas, marque V para as afirmativas verdadeiras e F para as falsas.
( ) Durante períodos de esforço vigoroso grandes quantidades de CO2 são produzidas pelo metabolismo, que desloca o equilíbrio para a direita, diminuindo o pH.
( ) Quando o sangue atinge os tecidos nos quais a concentração de O2 é baixa, o equilíbrio desloca‐se para a esquerda e O2 é liberado.
( ) Durante períodos de esforço vigoroso, à medida que O2 é consumido, o equilíbrio desloca‐se para a direita de acordo com o princípio de Le châtelier.
( ) A remoção de CO2 por exalação desloca o equilíbrio para a direita, consumindo íons H+ .
A sequência está correta em

Dados: M(g/mol): C = 12, S = 32; O = 16, N = 14, K = 39
Para formular uma mistura baseada na estequiometria da reação, a proporção em massa dos constituintes enxofre, carvão vegetal e salitre na mistura deve ser, respectivamente:

A partir das informações fornecidas, é correto afirmar que a principal interação entre o cristal violeta e a parede celular é:
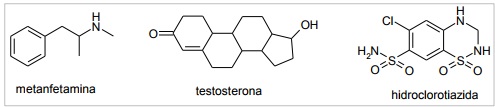
Sobre as substâncias utilizadas em doping, apresentadas na questão anterior, considere as seguintes afirmativas:
1. A metanfetamina possui uma amina secundária.
2. A testosterona é um composto aromático.
3. A testosterona possui função cetona.
4. A hidroclorotiazida é um sal.
Assinale a alternativa correta.
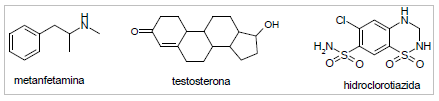
A partir das estruturas das três substâncias, analise as afirmativas a seguir:
1. A testosterona possui seis carbonos quirais.
2. A metanfetamina possui dois isômeros ópticos.
3. A hidroclorotiazida possui isômeros geométricos.
4. As três substâncias utilizadas em doping apresentam algum tipo de isomeria.
Assinale a alternativa correta.
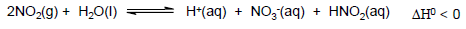
Num ensaio em laboratório, foram acondicionados num sistema fechado N2(g), O2(g), NO2(g) e vapor de água que está em equilíbrio com água líquida. A partir desses dados, considere as seguintes afirmações:
1. O aumento na pressão total do sistema tenderá a diminuir o pH da solução dentro do sistema.
2. Um aquecimento brando tenderá a aumentar o pH da solução dentro do sistema.
3. A adição de excesso de água líquida no sistema tenderá a deslocar o equilíbrio, diminuindo o pH da solução dentro do sistema.
4. A contribuição do ácido nitroso (HNO2) para o pH da solução dentro do sistema é desprezível.
Assinale a alternativa correta
(Notícia disponível em acesso em 08 ago. 2013.)
O texto extraído da notícia informa que o produto utilizado para fraudar o leite continha ureia e formol, compostos que possuem estruturas semelhantes, como mostrado ao lado.
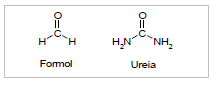
Com base nas estruturas, analise as seguintes afirmações:
1. O número de oxidação do carbono na ureia é maior (mais positivo) que do carbono no formol.
2. A carga formal do carbono da ureia é maior (mais positivo) que do carbono no formol.
3. Em ambos os casos a hibridização do carbono é sp2 .
4. Formol é um álcool.
Assinale a alternativa correta.
No modelo atômico de Bohr:
1. O elétron circula em órbita com raio definido.
2. O elétron é descrito por uma função de onda.
3. Para descrever o elétron num orbital são necessários 4 números quânticos.
4. Toda a massa do átomo está concentrada no núcleo, que ocupa uma porção ínfima do espaço.
Entre as afirmativas acima, correspondem ao modelo atômico de Bohr: