Questões Militares Sobre química
Foram encontradas 2.062 questões
Sobre o incidente do meteoro russo, assinale a alternativa correta:
Sobre a fumaça que anuncia a escolha do papa, assinale a alternativa correta:
Considerando que o saco plástico e o ar em seu interior formam o sistema observado e que o ar comporta-se como um gás ideal, o aluno descreveu as seguintes conclusões: I – Antes de atingir o volume máximo do saco plástico, a variação da energia interna do sistema é nula. II – O trabalho realizado pelo sistema é igual a zero. III – Trata-se de um sistema adiabático. IV – Devido ao aumento do volume do saco plástico, deduz-se que a massa de ar no interior do saco também aumentou.
Julgue se as conclusões do aluno são verdadeiras (V) ou falsas (F) e assinale a alternativa correta:
O composto mais comum de cálcio é o carbonato de cálcio, que ocorre naturalmente na forma de calcário. O calcário é decomposto por aquecimento em óxido de cálcio e dióxido de carbono. Por sua vez, o óxido de cálcio reage exotermicamente com a água, formando o hidróxido de cálcio, conhecido como cal apagado.
Assinale a alternativa que apresenta corretamente as fórmulas químicas dos compostos citados no texto: carbonato de cálcio, óxido de cálcio, dióxido de carbono e hidróxido de cálcio:
Com relação aos metais Pb, Ba e Sb: I – O raio atômico do Pb é maior que o do Ba e Sb. II – O Ba é mais eletronegativo que o Pb e menos que o Sb. III – O potencial de ionização aumenta na sequência Ba, Pb e Sb. IV – O Pb é mais denso que o Sb e o Ba.
A afirmativa correta é:
Devido ao aspecto dourado do fungo que a produz, a clortetraciclina é conhecida também como aureomicina, um antibiótico pertencente à classe das tetraciclinas. A estrutura química é apresentada a seguir:
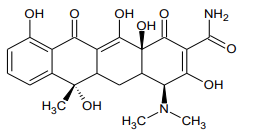
As funções orgânicas presentes na molécula são:
“Um relatório médico obtido com exclusividade pela redetelevisiva Al Jazeera aponta que foram encontrados níveis de polônio radiativo ao menos 18 vezes acima do normal nos restos mortais do líder palestino Yasser Arafat [...]. O isótopo de Polônio-210 não apresenta risco para a saúde humana se estiver fora do corpo. Caso ingerido ou inalado, mesmo em pequenas quantidades como 0,1 microgramas se tornam fatais”.
Fonte: <http://www1.folha.uol.com.br/mundo/2013/11/1367608-relatorio-de-medico-suicos-aponta-morte-de-yasser-arafat-por-envenenamento.shtml>. Acesso em: 13.março.2014.
Elementos radiativos podem ser bem aplicados,
tais como obtenção de imagens de radiografia,
tratamento de doenças, análises de materiais, usinas
termonucleares, entre outras aplicações. Dos
elementos listados, assinale o elemento que não é
radioativo:
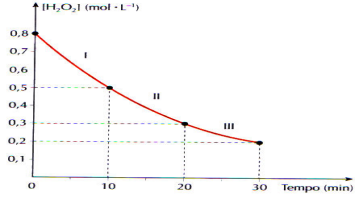 Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min:
Calcule a velocidade média de decomposição da água
oxigenada, em mol.L-1.min-1, nos intervalos I, II, I e no
intervalo de 0 a 30 min: A cocaína é um alcalóide cujo uso prolongado leva à dependência física, a períodos de grande depressão, podendo causar a morte. É também um anestésico local. A coniína é um outro alcalóide muito tóxico; sua ingestão pode causar fraqueza, tonturas, náuseas, respiração difícil, paralisia e morte. A coiína é uma substância tóxica da planta de nome cicuta, utilizada na execução do filósofo Sócrates. Abaixo, estão as estruturas químicas da cocaína e da coniína:
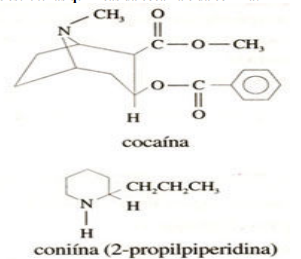
Segundo as fórmulas estruturais representadas é correto afirmar que:
I - Ambas são classificadas como bases orgânicas.
II - Possuem grupo funcional Amina, composto responsável pelo teor entorpecente causador da dependência, pois age direto nas funções psico – neurológicas.
III - Apresentam fórmulas moleculares: (C17H21O4, C8H17N).
IV - Apresentam os grupos funcionais: Amida, Ácido Carboxílico, e Benzeno.
V - São compostos heterogênicos e Alicíclico.
VI - Compostos covalentes, iônicos, insaturados, fazem as ligações de hidrogênio com a água.
Estão corretas:
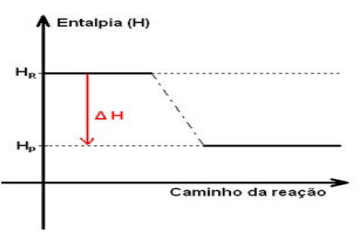
De acordo com o gráfico acima pode concluir se que trata se de uma reação Hp = 250, Hr = 480: I - Espontânea. II - Exotérmica, pois ocorreu um ganho de energia. III - Necessita apenas de um estímulo para que ocorra. IV - Sendo o Hp = 250 kj e Hr = 480kj o delta será de +130 kj. V - Endotérmica, pois ocorreu uma perda de energia. VI - Sendo o Hp = 250 e Hr = 480 delta H será de -130kj. Estão incorretas:
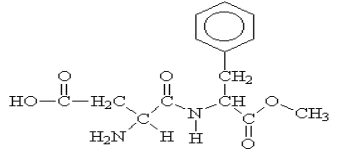
Apresenta os agrupamentos funcionais:
O ciprofloxacino um antibiótico “base orgânica” administrado por via oral ou intravenosa no tratamento de infecções urinárias, passou também a ser usado, no combate ao microorganismo Bacillus anthracis, este antibiótico possui a fórmula estrutural a seguir:
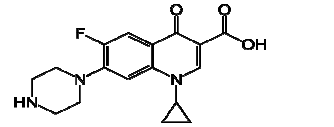
Com base na fórmula estrutural do ciprofloxacino é correto afirmar que:
I - Este composto pertence aos grupos funcionais como: cetona, amina, ácido carboxílico e aleto orgânico.
II - É um composto alifático saturado.
III - C16H18N3O3F.
IV - O percentual do Carbono é de 61,6%.
V - Um composto heterogênio de cadeia mista.
Estão corretas:
Certo composto β é produzido através da reação:
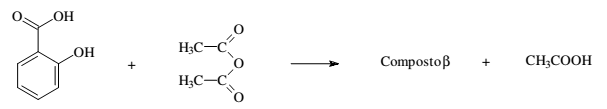
Dois bécheres são colocados em um sistema fechado, mantido a 40 °C. O bécher da esquerda contém 200 mL de etanol, enquanto o da direita contém uma solução de 500 mg do composto β em 200 mL de etanol, conforme a representação a seguir.
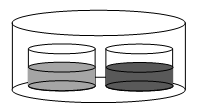
Assinale a alternativa que melhor representa os níveis de líquido nos bécheres três horas após o início do
confinamento.
Realiza-se a eletrólise de uma solução aquosa diluída de ácido sulfúrico com eletrodos inertes durante 10 minutos. Determine a corrente elétrica média aplicada, sabendo-se que foram produzidos no catodo 300 mL de hidrogênio, coletados a uma pressão total de 0,54 atm sobre a água, à temperatura de 300 K.
Considere:
• Pressão de vapor da água a 300 K = 0,060 atm;
• Constante de Faraday: 1 F = 96500 C.mol–1;
• Constante universal dos gases perfeitos: R = 0,08 atm.L.K–1.mol–1
.
Um experimento clássico indica que o oxigênio molecular (O2) exibe propriedades magnéticas no seu estado fundamental. O experimento consiste em fazer passar oxigênio líquido pelos polos de um ímã. Observa-se que o oxigênio fica retido, como mostra a figura a seguir:
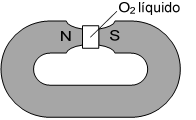
Nas alternativas abaixo, são apresentados os orbitais 2p de dois átomos de oxigênio e o spin dos elétrons que ocupam seus orbitais atômicos. Também são apresentadas possíveis interações químicas que podem resultar em ligações químicas estabelecidas entre esses dois átomos.
Considerando a observação experimental e os requisitos eletrônicos e energéticos para o
estabelecimento de ligações químicas, indique qual das alternativas abaixo representa melhor o O2 no
estado fundamental.
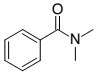
Dada a estrutura da N,N-dimetilbenzamida abaixo é incorreto afirmar que essa molécula