Questões Militares Sobre química
Foram encontradas 2.062 questões
Águas termais, exploradas em diversos destinos turísticos, brotam naturalmente em fendas rochosas. O aquecimentonatural dessas águas, na sua grande maioria, deve-se ao calor liberado em processos radioativos de elementospresentes nos minerais rochosos que são transferidos para a água no fluxo pelas fendas. O gás radônio (222Rn) é oprovável responsável pelo aquecimento de diversas águas termais no Brasil. O 222Rn se origina do rádio (226Ra), nasérie do urânio (238U), naturalmente presente em granitos. O tempo de meia vida (t1/2) do 222Rn é de 3,8 dias, e esse seconverte em polônio (218Po), que por sua vez possui um t1/2 de 3,1 minutos. Considerando as informações dadas,considere as seguintes afirmativas:
1. A conversão de 222Rn em 218Po é um processo exotérmico.
2. A conversão de 226Ra em 222Rn emite quatro partículas β-.
3. Na série de decaimento, do 238U ao 218Po, cinco partículas α são emitidas.
4. Após 3,8 dias da extração da água termal, a concentração de 218Po atingirá a metade do valor da concentraçãoinicial de 222Rn.
Assinale a alternativa correta
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
1a Etapa: o composto A (C7H6O) sofre oxidação em solução básica de permanganato de potássio. O produto gerado, após neutralizado, é o ácido benzoico;
2a Etapa: o ácido benzoico reage com etanol em solução ácida, produzindo o composto B e água;
3a Etapa: o composto B sofre forte redução com hidreto de lítio-alumínio em éter, gerando dois produtos que, depois de neutralizados, formam então o composto C e o etanol.
Considerando as etapas supracitadas, são feitas as seguintes afirmações:
I) o composto A e o composto C são isômeros.
II) o composto B é um éster.
III) o composto B é o acetato de benzila.
Com base na análise das afirmações acima, assinale a opção correta.
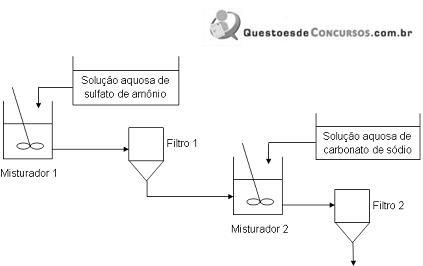
No Misturador 1, antes da adição de 100 mL de uma solução aquosa de sulfato de amônio 20 g/L, encontram-se 100 mL de uma solução aquosa composta por massas iguais de nitrato de prata, nitrato cúprico e nitrato de chumbo (II), de concentração total 60 g/L.
Ao Misturador 2, que contém o material passante do Filtro 1, adicionam-se 100 mL de uma solução aquosa de carbonato de sódio 40 g/L e uma pequena quantidade de uma solução de hidróxido de sódio objetivando o adequado ajuste do pH de precipitação para, em seguida, proceder a filtração. Sobre os produtos de filtração, pode se dizer que:
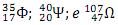
marque a alternativa correta, considerando-se as condições de 1 atm e 25 ?.
I. Acetona;
II. Neopentano;
III. Fluoreto de lítio;
IV. Etanamida;
V. Pentano.
Assinale a alternativa que apresenta a sequência correta, conforme a ordem crescente de ponto de ebulição.
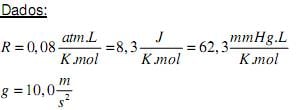
As equações que representam as semirreações de cada espécie e os respectivos potenciais- padrão de redução (25 ºC e 1 atm) são apresentadas a seguir.
Zn2+(aq) + 2 e- → Zn (s) Eo = - 0,76 V
Ag+ (aq) + 1 e- → Ag (s) Eo = + 0,80 V
Com base nas informações apresentadas são feitas as afirmativas abaixo.
I – No eletrodo de zinco ocorre o processo químico de oxidação.
II – O cátodo da pilha será o eletrodo de prata.
III – Ocorre o desgaste da placa de zinco devido ao processo químico de redução do zinco.
IV – O sentido espontâneo do processo será Zn+2 + 2 Ago → Zno + 2 Ag+
V – Entre os eletrodos de zinco e prata existe uma diferença de potencial padrão de 1,56 V.
Estão corretas apenas as afirmativas
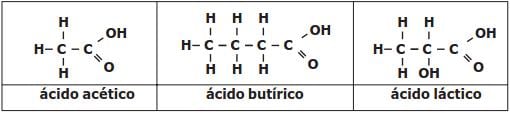
Com relação a estas substâncias citadas, são feitas as afirmativas abaixo.
I – Ácido Acético é a nomenclatura usual do composto que, segundo a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC), é denominado de ácido metanóico.
II – As substâncias apresentadas possuem na estrutura grupos que caracterizam a função química ácido carboxílico.
III – O motivo de o ácido láctico apresentar maior ponto de fusão que o ácido butírico pode ser atribuído aos fatos de o ácido láctico ter maior massa molecular e de ser capaz de estabelecer maior número de fortes interações intermoleculares.
Dados:
- massas atômicas: C = 12 u ; H = 1 u; O = 16 u
Das afirmativas apresentadas está(ão) correta(s)
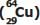 é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação
é de apenas 12,8 horas, pois ele sofre decaimento β se transformando em zinco, conforme a representação  .
. Considerando uma amostra inicial de 128 mg de cobre-64, após 76,8 horas, a massa restante desse radioisótopo será de:
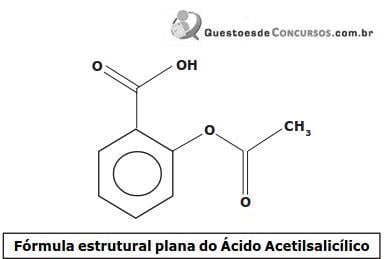
Considerando a fórmula estrutural plana simplificada do AAS, a alternativa que apresenta corretamente a fórmula molecular do composto e os grupos funcionais orgânicos presentes na estrutura é:
Cu (s) + HNO3 (aq) → Cu(NO3)2 (aq) + NO (g) + H2O (l)
Após o balanceamento da equação com os coeficientes estequiométricos (menores números inteiros) a soma destes coeficientes será igual a
Dados: 1H1; 6C12; 8O16; 16S32; 7N14