Questões Militares Sobre química
Foram encontradas 2.077 questões
CrI3 + Cl2 + NaOH → NaIO4 + Na2CrO4 + NaCl + H2O
Assinale a alternativa que indica a soma dos menores coeficientes inteiros capazes de balancear a equação química acima:
Em um recipiente fechado queima-se propano com 80% da quantidade estequiométrica de ar. Admitindo que não haja hidrocarbonetos após a combustão, que todos os produtos da reação estejam na fase gasosa e que a composição volumétrica do ar seja de uma parte de O2 para quatro partes de N2, calcule a porcentagem molar de CO2 no recipiente após a combustão (considere comportamento ideal para os gases).
Considere as seguintes possibilidades para a estrutura da molécula de trifluoreto de cloro (ClF3):
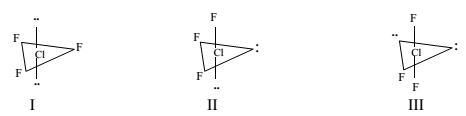
Assinale a alternativa correta.
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Observe as estruturas abaixo e analise as afirmativas feitas sobre elas.
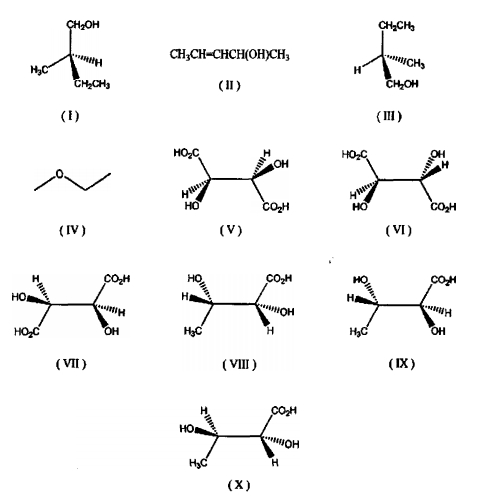
1 - As estruturas (I) e (IV) representam isômeros constitucionais.
2 - As estruturas (I) e (III) representam um par de enantiômeros.
3 - Existem quatro estereoisômeros que têm a fórmula estrutural condensada (II).
4 - Os compostos (V) e (VII) apresentam pontos de fusão idênticos.
5 - As estruturas (VIII) e (IX) representam um par de diastereoisômeros.
6 - Todos os compostos (V) a (X) apresentam atividade óptica.
7 - As estruturas (VIII) e (X) são representações do mesmo composto.
Podemos concluir que são verdadeiras as afirmativas:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
A taxa de emissão de dióxido de carbono em função do consumo médio de certo combustível, em um carro de testes, é apresentada a seguir.
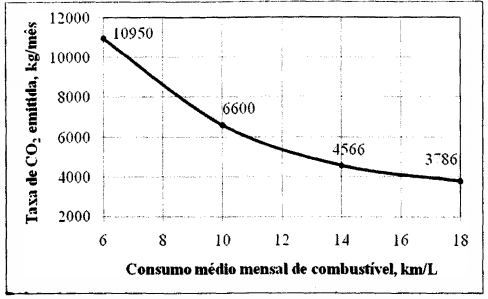
Para um consumo médio de 10 km/L, a massa total mensal de combustível consumida é 2175
kg. Dentre as opções abaixo, pode-se afirmar que o combustível testado foi o:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
considere as espécies de (I) a (IV) e o arcabouço da Tabela Periódica representados a seguir. Assinale a alternativa correta.
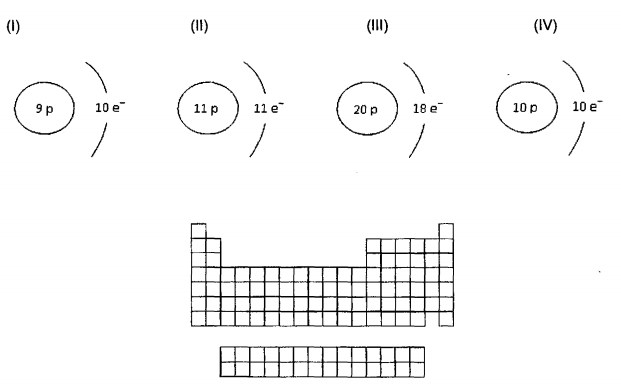
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Marque a resposta certa, corresponde aos números de oxidação dos elementos sublinhados em cada fórmula, na ordem em que estão apresentados.
AgO; NaO2; H2S2O8; Ni(CO)4; U3O8
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Certo composto β é produzido através da reação:
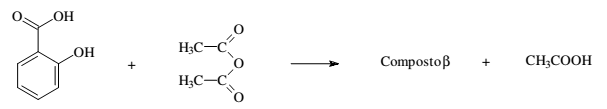
Dois bécheres são colocados em um sistema fechado, mantido a 40 °C. O bécher da esquerda contém 200 mL de etanol, enquanto o da direita contém uma solução de 500 mg do composto β em 200 mL de etanol, conforme a representação a seguir.
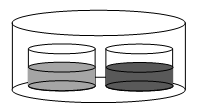
Assinale a alternativa que melhor representa os níveis de líquido nos bécheres três horas após o início do
confinamento.
Realiza-se a eletrólise de uma solução aquosa diluída de ácido sulfúrico com eletrodos inertes durante 10 minutos. Determine a corrente elétrica média aplicada, sabendo-se que foram produzidos no catodo 300 mL de hidrogênio, coletados a uma pressão total de 0,54 atm sobre a água, à temperatura de 300 K.
Considere:
• Pressão de vapor da água a 300 K = 0,060 atm;
• Constante de Faraday: 1 F = 96500 C.mol–1;
• Constante universal dos gases perfeitos: R = 0,08 atm.L.K–1.mol–1
.
Um experimento clássico indica que o oxigênio molecular (O2) exibe propriedades magnéticas no seu estado fundamental. O experimento consiste em fazer passar oxigênio líquido pelos polos de um ímã. Observa-se que o oxigênio fica retido, como mostra a figura a seguir:
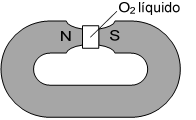
Nas alternativas abaixo, são apresentados os orbitais 2p de dois átomos de oxigênio e o spin dos elétrons que ocupam seus orbitais atômicos. Também são apresentadas possíveis interações químicas que podem resultar em ligações químicas estabelecidas entre esses dois átomos.
Considerando a observação experimental e os requisitos eletrônicos e energéticos para o
estabelecimento de ligações químicas, indique qual das alternativas abaixo representa melhor o O2 no
estado fundamental.
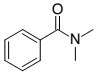
Dada a estrutura da N,N-dimetilbenzamida abaixo é incorreto afirmar que essa molécula
Considere a reação catalisada descrita pelo mecanismo a seguir.
Primeira etapa: A + BC → AC + B
Segunda etapa: AC + D → A + CD
O perfil energético dessa reação segue a representação do gráfico abaixo.
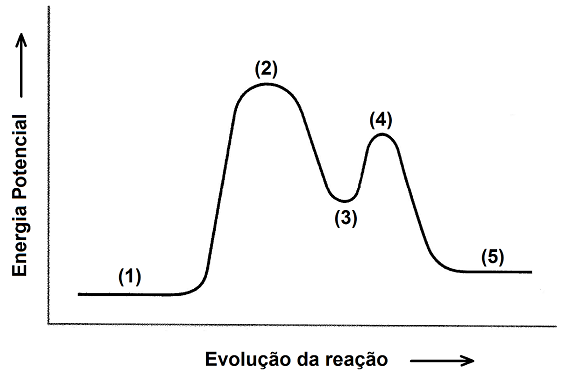
Diante das informações apresentas, é correto afirmar que
Em 19,9 g de um sal de cálcio encontra-se 0,15 mol desse elemento. Qual a massa molar do ânion trivalente que forma esse sal?
Dado: Ca = 40 g/mol.