Questões Militares Sobre química
Foram encontradas 2.015 questões
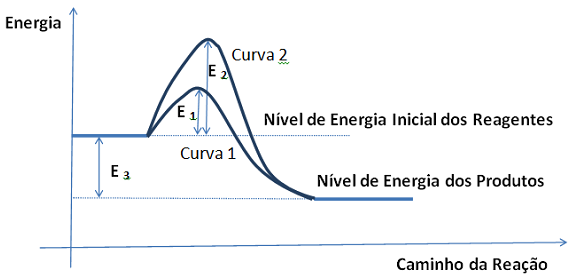
O gráfico abaixo ilustra as variações de energia devido a uma reação química conduzida nas mesmas condições iniciais de temperatura, pressão, volume de reator e quantidades de reagentes em dois sistemas diferentes. Estes sistemas diferem apenas pela presença de catalisador. Com base no gráfico, é possível afirmar que:
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
Dados:
Massas atômicas: H = 1,00 u, O = 16,0 u, Na = 23,0 u, Cl = 35,5 u
Dadas as reações:
PCl3 + 3H2O → H3PO3 + 3HCl
PCl5 + 4H2O → H3PO4 + 5HCl
Assinale a afirmativa correta:
Assinale a alternativa que completa correta e respectivamente as lacunas da afirmativa a seguir.
Em um átomo em equilíbrio, o número de _________ é igual a(ao) _____________.
Considere os fenômenos cotidianos apresentados a seguir:
I - Uma bolinha de naftalina esquecida no guarda-roupas.
II - Um pote contendo água colocado no congelador.
III - Uma toalha molhada estendida no varal.
IV - O derretimento de uma bola de sorvete.
Supondo que cada caso seja observado por tempo o bastante para que todos evidenciem alterações na matéria, marque a opção que relaciona corretamente o fenômeno ao nome da mudança de estado físico.
I. H3C – CH2 – CH2 – OH com H3C – CH2 – CH2 – OH.
II. HBr com HBr.
III. CH3NH2 com CH3NH2.
IV.C5H12 com C5H12.
Sobre o tipo de forças intermoleculares que existem em cada uma das substâncias anteriores, assinale a alternativa correta.