Questões Militares Sobre química
Foram encontradas 2.077 questões
Ponto de ebulição dos hidretos do grupo 4A e 6A em função da massa molecular.
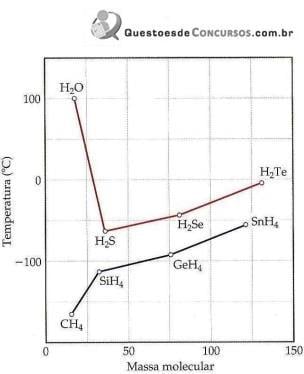
(Química Ciência Central.)
Sobre a imagem e intensidade das forças intermoleculares, analise.
I. No geral, o ponto de ebulição de compostos de hidrogênio torna-se maior com o aumento da massa molecular, devido ao acréscimo das forças de dispersão.
II. Os compostos NH3 e HF também têm pontos de ebulição altos.
III. A ligação de hidrogênio é um tipo de atração intermolecular entre o átomo de hidrogênio em uma ligação apolar (particularmente uma ligação com F, O ou N) e um par de elétrons não compartilhado em um íon ou átomo pequeno e eletronegativo que esteja próximo (geralmente um átomo de F, O ou N em outra molécula).
Está(ão) correta(s) apenas a(s) afirmativa(s)
( ) Ao adicionar solução de fenolftaleína em um meio ácido a solução ficará incolor, pois o aumento da concentração de H+ desloca o equilíbrio.
( ) O ácido carbônico é um ácido fraco, extremamente instável, que se forma somente em equilíbrio dinâmico entre a água e o gás carbônico.
( ) Quando reagem com o zinco produzem hidrogênio gasoso.
( ) Reagem com carbonatos e bicarbonatos para produzir monóxido de carbono.
A sequência está correta em
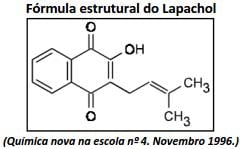
A partir da fórmula estrutural do lapachol, analise as afirmativas.
I. Possui massa molar de, aproximadamente, 242 g/mol.
II. Possui fórmula molecular C15H14O3.
III. Possui em sua estrutura as funções orgânicas fenol e éster.
Está(ão) correta(s) apenas a(s) afirmativa(s)
(---) Se a concentração molar de N2O5 for duplicada, a velocidade da reação será reduzida à metade.
(---) Se a concentração molar de N2O5 for triplicada, a velocidade da reação também triplicará.
(---) Se a concentração molar de N2O5 for reduzida à metade, a velocidade da reação duplicará.
A concentração de um solvente em um processo que ocorre em solução aquosa e do qual a água participa como reagente irá variar de acordo com a quantidade de soluto da solução: quanto mais soluto, menor a concentração do solvente (1ª parte). A água mineral de locais onde exista calcário é alcalina devido à presença de CaCO3 (Carbonato de Cálcio) dissolvido, presente no calcário, que, ao sofrer hidrólise salina, deixa o meio básico (2ª parte).
A sentença está:
I - Os átomos de um mesmo elemento químico não precisam apresentar o número de nêutrons em comum.
II - Para que um átomo neutro do elemento químico Ferro transforme-se no íon Fe2+ , ele deve perder 2 elétrons.
III - O Diagrama de Pauling apresenta a posição dos elétrons na eletrosfera.
Está(ão) CORRETO(S):
Abaixo é mostrada a reação entre essas duas substâncias.
Al2(SO4)3 + 3 Ca(OH)2
 2 Al(OH)3 + 3 CaSO4
2 Al(OH)3 + 3 CaSO4Como pode ser classificada essa reação?
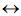 C(g) + 2 D(g) foram levantados os seguintes dados:
C(g) + 2 D(g) foram levantados os seguintes dados: 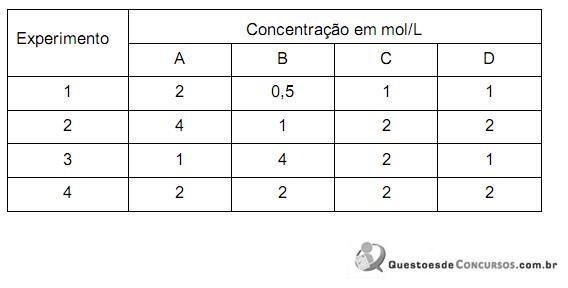
Dos experimentos realizados, um ainda não atingiu o equilíbrio.
O experimento que NÃO atingiu o equilíbrio é o
Em relação à concentração de uma das espécies resultante na mistura final, é CORRETO afirmar que
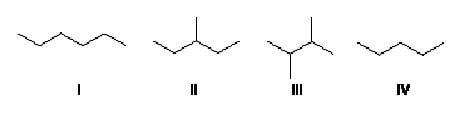
A ordem crescente de ponto de ebulição para essas substâncias é