Questões Militares Sobre química
Foram encontradas 2.077 questões
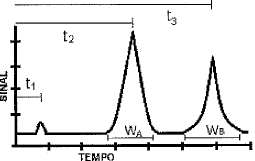
O gráfico acima apresenta uma resposta típica de uma cromatografia gasosa, na qual as substâncias gasosas atravessam uma coluna em diferentes velocidades e tempos de retenção distintos, sendo medidos por um detector no final do cromatógrafo. O terceiro pico representa o sinal medido da substância B. O tempo de retenção ajustado da substância B é representado por:
( ) No meio não aerado, o hidrogênio pode ficar adsorvido na superfície do catodo, polarizando a pilha formada com conseqüente redução do processo corrosivo.
( ) Se o oxigênio puder ser rápido e uniformemente fornecido a uma superfície metálica, é possível reparar fraturas que ocorram na película, diminuindo-se, assim, a velocidade de corrosão.
( ) O cobre tem uma velocidade de corrosão rápida em presença de ácidos não oxidantes, e em presença de oxigênio este vai funcionar como estimulador de corrosão.
( ) A corrosão eletroquímica será tanto mais intensa quanto maior o valor do pH.
( ) O cobre se mostra eficaz quando disperso em resina, geralmente epóxi, ou em silicatos inorgânicos ou orgânicos.
( ) No mecanismo de barreira, a eficiência da proteção depende da espessura do revestimento e da resistência das tintas ao meio corrosivo.
( ) No mecanismo de inibição, as tintas de fundo contêm determinados pigmentos inibidores que dão origem à formação de uma camada passiva sobre a superfície do metal, impedindo a sua passagem para a forma iônica.
Os pigmentos inorgânicos, em geral, possuem melhor resistência à radiação solar, em especial aos raios ultravioleta, do que os orgânicos que, por sua vez, para determinadas cores, possuem melhor resistência química do que os inorgânicos.
Associe as duas colunas relacionando os pigmentos inorgânicos com as suas características.
(1) Dióxido de titânio
(2) Zarcão
(3) Óxido de ferro vermelho
(4) Alumínio
( ) Na presença de ácidos graxos de óleos vegetais, confere proteção anticorrosiva ao aço pelo mecanismo de passivação ou inibição anódica.
( ) Apresenta resistência química bastante satisfatória e um custo relativamente baixo.
( ) Pode ser encontrado sob duas formas de estrutura cristalina: rutilo e anatásio.
( ) Uma das propriedades mais importantes é o formato lamelar das partículas.
A seqüência está correta em
A análise dos dados termodinâmicos de reações permite a previsão da espontaneidade. Na tabela a seguir estão apresentados os dados termodinâmicos de duas reações químicas.
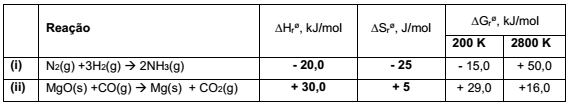
A partir dos dados apresentados, identifique as seguintes afirmativas como verdadeiras (V) ou falsas (F):
( ) A diminuição da temperatura desfavorece a espontaneidade da reação (i).
( ) O aumento da temperatura favorece a espontaneidade da reação (ii).
( ) Na temperatura de 400 K, a reação (i) será espontânea.
( ) Na temperatura de 4000 K, a reação (ii) será espontânea.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A retina do olho humano contém dois tipos de células especializadas: os cones e os bastonetes. Nos bastonetes acontece uma transformação química fundamental para a química da visão. Trata-se da conversão do retinol (Vitamina A) em retinal que, na sequência, sofrerá outras transformações.
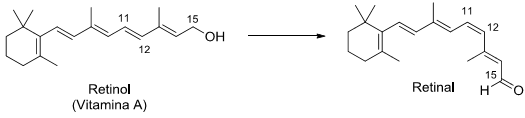
Sobre o tema, considere as seguintes afirmativas:
1. O grupo funcional álcool no retinol é convertido a aldeído no retinal.
2. A ligação dupla entre os carbonos 11 e 12 sofre uma reação de isomerização.
3. A molécula do retinal apresenta um grau de oxidação superior ao do retinol.
4. A molécula do retinol apresenta um centro quiral no carbono 15.
Assinale a alternativa correta.
A reação de hidrólise da acetilcolina, esquematizada abaixo, é fundamental na transmissão de impulsos nervosos nos seres vivos. A reação é promovida pela enzima acetilcolinesterase (AChE).
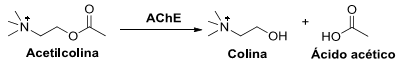
Considere as seguintes afirmativas sobre o papel de AChE nessa reação:
1. AChE é catalisador da reação.
2. AChE aumenta a energia de ativação da reação.
3. AChE promove caminhos reacionais alternativos.
4. AChE inibe a formação de intermediários.
Assinale a alternativa correta.
O salicilato de metila é um produto natural amplamente utilizado como analgésico tópico para alívio de dores musculares, contusões etc. Esse composto também pode ser obtido por via sintética a partir da reação entre o ácido salicílico e metanol, conforme o esquema abaixo:
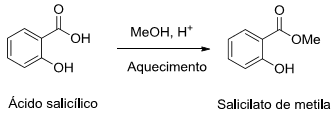
A reação esquematizada é classificada como uma reação de:
O palito de fósforo é um dos artigos mais úteis no nosso cotidiano. Na sua composição, possui fósforo vermelho, enxofre e clorato de potássio. A cabeça de um palito de fósforo pesa aproximadamente 0,05 g. A reação que ocorre na queima da cabeça de fósforo está representada a seguir:
3 P4 + S + 10 KClO3 + O2 → 3 P4O10 + 10 KCl + SO2
O cheiro característico de “fósforo queimado” se deve ao dióxido de enxofre formado.
Dados: No palito de fósforo, os componentes estão em quantidades estequiométricas. M (g mol-1): Cl = 35,5; K = 39; O= 16;P = 31; S = 32.
A massa (em g) de dióxido de enxofre produzido ao queimar uma cabeça de fósforo é aproximadamente:
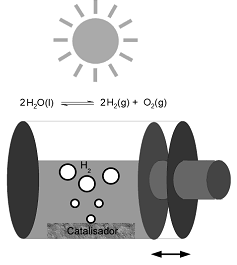
Recentemente, a produção fotocatalítica de hidrogênio vem atraindo atenção devido ao processo que gera um combustível limpo, o qual é utilizado em células a combustível. O processo se baseia na separação da água nos seus componentes, conforme equilíbrio inserido no esquema, utilizando luz solar e um fotocatalisador (p. ex. NaTaO3:La). O processo é extremamente endotérmico, necessitando 1,23 eV para ocorrer. Num experimento, o processo foi realizado num sistema fechado, como esquematizado abaixo. Considerando essas informações, identifique as afirmativas a seguir como verdadeiras (V) ou falsas (F):
( ) A quantidade de fotocatalisador limita a conversão.
( ) O aumento da temperatura irá favorecer a conversão.
( ) A diminuição do volume do sistema irá favorecer a conversão.
( ) É condição necessária para a produção de hidrogênio que o fotocatalisador absorva energia solar superior a 1,23 eV.
Assinale a alternativa que apresenta a sequência correta, de cima para baixo.
A biodegradação da matéria orgânica produz substâncias húmicas, nas quais os principais componentes são os ácidos húmicos. Estes correspondem a diversas estruturas complexas, que possuem na maioria substituintes fenólicos (pKa = 8) e carboxílicos (pKa = 4). Além de alterar o pH do meio, também são capazes de se ligar a íons metálicos formando coloides. Sobre esse tema, considere as seguintes afirmativas:
1. A presença de substâncias húmicas torna o pH menor que 7. 2. A presença de substâncias húmicas ligadas a íons metálicos é detectada pelo turvamento do meio.
3. O valor medido de pH 6 em uma amostra indica que praticamente todos os substituintes fenólicos estão protonados, enquanto que os substituintes carboxílicos estão desprotonados.
4. O valor medido de pH 4 em uma amostra indica que 50% dos substituintes carboxílicos estão protonados.
Assinale a alternativa correta.
Águas termais, exploradas em diversos destinos turísticos, brotam naturalmente em fendas rochosas. O aquecimentonatural dessas águas, na sua grande maioria, deve-se ao calor liberado em processos radioativos de elementospresentes nos minerais rochosos que são transferidos para a água no fluxo pelas fendas. O gás radônio (222Rn) é oprovável responsável pelo aquecimento de diversas águas termais no Brasil. O 222Rn se origina do rádio (226Ra), nasérie do urânio (238U), naturalmente presente em granitos. O tempo de meia vida (t1/2) do 222Rn é de 3,8 dias, e esse seconverte em polônio (218Po), que por sua vez possui um t1/2 de 3,1 minutos. Considerando as informações dadas,considere as seguintes afirmativas:
1. A conversão de 222Rn em 218Po é um processo exotérmico.
2. A conversão de 226Ra em 222Rn emite quatro partículas β-.
3. Na série de decaimento, do 238U ao 218Po, cinco partículas α são emitidas.
4. Após 3,8 dias da extração da água termal, a concentração de 218Po atingirá a metade do valor da concentraçãoinicial de 222Rn.
Assinale a alternativa correta
“Gelo de fogo” escondido em permafrost é fonte de energia do futuro? Conhecido como "gelo que arde", o hidrato de metano consiste em cristais de gelo com gás preso em seu interior. Eles são formados a partir de uma combinação de temperaturas baixas e pressão elevada e são encontrados no limite das plataformas continentais, onde o leito marinho entra em súbito declive até chegar ao fundo do oceano. Acredita-se que as reservas dessa substância sejam gigantescas. A estimativa é de que haja mais energia armazenada em hidrato de metano do que na soma de todo petróleo, gás e carvão do mundo. Ao reduzir a pressão ou elevar a temperatura, a substância simplesmente se quebra em água e metano – muito metano. Um metro cúbico do composto libera cerca de 160 metros cúbicos de gás a pressão e temperatura ambiente, o que o torna uma fonte de energia altamente intensiva.
Disponível em: http://www.bbc.co.uk/portuguese/noticias/2014/04/140421_energia_metano_ms.shtml.
Acessado em 21/04/2014. Texto adaptado.
Dado: R = 8,2 x 10-5 m3 atm K-1 mol-1
Para armazenar todo o gás do interior de 1 m3 de “gelo de fogo” num cilindro de 1 m3 e a temperatura de 0°C, é necessária uma pressão (em atm) de
A tiroxina é um hormônio produzido e armazenado na glândula tireóide. Tem como função regular a velocidade do metabolismo e a oxigenação dos tecidos. Sua produção se dá na presença de iodo e datirosina, sendo armazenados na forma de proteína.
A fórmula química da tiroxina é
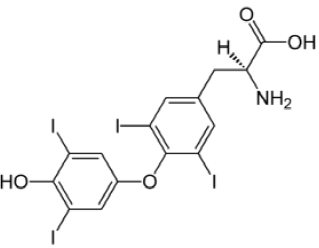
A função química orgânica que NÃO está presente nesse hormônio é
CH4(g) + 2 O2(g) ->CO2(g) + 2 H2O(g) ΔH = -802 kJ
Se utilizarmos 4 mol de CH4 e 4 mol de O2 para uma nova reação, a quantidade de calor liberada será de