Questões Militares
Sobre representação das transformações químicas em química
Foram encontradas 293 questões
Os átomos de um elemento Z cujo número atômico é 20 se unem com os átomos de um elemento Y cujo número atômico é 7 através de uma ligação iônica. Qual a fórmula do composto formado por esses dois elementos?
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
A taxa de emissão de dióxido de carbono em função do consumo médio de certo combustível, em um carro de testes, é apresentada a seguir.
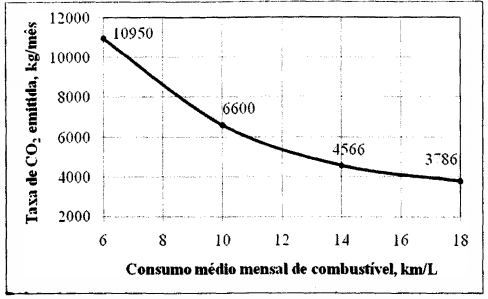
Para um consumo médio de 10 km/L, a massa total mensal de combustível consumida é 2175
kg. Dentre as opções abaixo, pode-se afirmar que o combustível testado foi o:
FOLHA DE DADOS
Massas Atômicas (u):
O = 16
C = 12
S = 32
H = 1
Na = 23
Ni = 59
Ag = 108
U = 238
Dados Termodinâmicos:
R = 0,082 atm.L.mol-1.K-1 = 8,314 J.mol-1K-1
Solução do frasco I: ficou rosa em fenolftaleína e amarela no metilorange.
Solução do frasco II: permaneceu incolor em fenolftaleína e vermelha no metilorange.
Solução do frasco III: permaneceu incolor em fenolftaleína e amarela no metilorange.
Sabe-se que a fenolftaleína, em pH acima de 9 apresenta coloração vermelha, enquanto que, em pH abaixo desse valor, é incolor. Sabe-se ainda que o metilorange apresenta coloração vermelha em pH abaixo de 3,5 e amarela em pH acima deste valor.
Sendo assim, os estudantes chegaram à conclusão de que os frascos I, II e III contêm, respectivamente, solução de
A 25 °C, as massas específicas do etanol e da água, ambos puros, são 0,8 g cm−3 e 1,0 g cm−3 , respectivamente. Adicionando 72 g de água pura a 928 g de etanol puro, obteve-se uma solução com 1208 cm3 de volume.
Assinale a opção que expressa a concentração desta solução em graus Gay-Lussac (°GL).
Considere a equação abaixo para responder a questão.

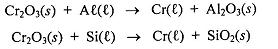
Após balancear as equações acima, assinale a alternativa correta.
PF5. SF4, SF6, SO42-, NO2, HCN, BF4-
Com relação a essas espécies pode-se afirmar que:
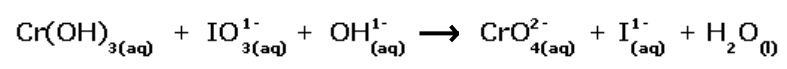
Considerando o método de balanceamento de equações químicas por oxi-redução, a soma total dos coeficientes mínimos e inteiros das espécies envolvidas, após o balanceamento da equação iônica, e o agente oxidante são, respectivamente,

As fórmulas químicas das substâncias citadas nesse quadro são, na ordem, respectivamente:
Etapa I S8(s) + O2(g) → SO2(g)
Etapa II SO2(g) + O2(g) → SO3(g)
Etapa III SO2(3) + H2O(l) → H2SO4(aq)
Considerando as etapas citadas e admitindo que o rendimento de cada etapa da obtenção do ácido sulfúrico por esse método é de 100%, então a massa de enxofre ( S8(s) ) necessária para produzir 49 g de ácido sulfúrico ( H2SO4(aq) ) é:

A seguinte reação não-balanceada e incompleta ocorre em meio ácido:
(Cr2O7 )-2 + (C2 O4)-2 → Cr3+ + CO2
A soma dos coeficientes estequiométricos da reação completa e balanceada é igual a
CrI3 + Cl2 + NaOH → NaIO4 + Na2CrO4 + NaCl + H2O
Assinale a alternativa que indica a soma dos menores coeficientes inteiros capazes de balancear a equação química acima:
