Questões Militares
Sobre representação das transformações químicas em química
Foram encontradas 289 questões
Analise as afirmações I, II, III e IV abaixo referente(s) à(s) característica(s) e/ou informação(ões) sobre algumas substâncias, nas condições ambientes:
I- A substância é a principal componente do sal de cozinha e pode ser obtida pela evaporação da água do mar. Dentre seus muitos usos podemos citar: a produção de soda cáustica e a conservação de carnes.
II- A substância é classificada como composta, e pode fazer parte da chuva ácida. Dentre seus muitos usos, podemos citar: utilização em baterias de automóveis e na produção de fertilizantes, como o sulfato de amônio.
III-A substância em solução aquosa é vendida em drogarias e utilizada como antisséptico e alvejante. Algumas pessoas utilizam essa substância para clarear pelos e cabelos.
IV-A substância é classificada como simples, tem seu ponto de ebulição igual a -195,8 ºC, é a mais abundante no ar atmoférico e reage com o gás hidrogênio produzindo amônia.
As substâncias que correspondem às afirmações I, II, III e IV são, respectivamente,
Um professor de Química, durante uma aula experimental, pediu a um de seus alunos que fosse até o armário e retornasse trazendo, um por um, nesta ordem: um oxiácido inorgânico; um diácido; um sal de metal alcalino; uma substância que, após aquecimento, pode gerar dióxido de carbono (CO2(g)); e um sal ácido.
Assinale a alternativa que corresponde à sequência de fórmulas moleculares que atenderia corretamente ao pedido do professor.
Na equação da reação de óxido-redução, representada no quadro abaixo, a soma dos menores coeficientes estequiométricos inteiros, necessários para balanceá-la, e o agente redutor são, respectivamente,

Uma quantidade de 5828 g de mistura de óxido de sódio(Na2O) e óxido de potássio(K2O) foi tratada com uma solução de ácido clorídrico que continha 300 mols de HCl. Admitindo-se que toda a mistura de óxidos reagiu com parte do HCl, e que o excesso de HCl necessitou de 144 mols de hidróxido de sódio(NaOH) para ser totalmente neutralizado, então a composição percentual, em massa de Na2O e de K2O era, respectivamente,

Sobre esse assunto, é correto afirmar que:
Bicarbonato 100,0
Cálcio 22,0
Sódio 8,98
Nitrato 4,11
Sulfato 6,00
Magnésio 3,26
Potássio 2,70
Cloreto 0,73
Fluoreto 0,34
Sabe-se que a massa molar do íon sulfato (SO42-) é de 96 g/mol. A quantidade de mols de íons sulfato contida em 16 L dessa água mineral é:
Cl2(g) + OH1-(aq) → Cl1-(aq) + ClO31-(aq) + H2O(l)
O carbonato de sódio (Na2CO3) empregado na fabricação de vidro é preparado a partir do carbonato de cálcio (CaCO3) e cloreto de sódio (NaCl), segundo a equação balanceada:
CaCO3 + 2 NaCl → Na2CO3 + CaCl2
Partindo-se de 1250 g de carbonato de cálcio (com grau de pureza de 80%) e 650 g de cloreto de sódio (com grau de pureza de 90%), a massa de carbonato de sódio (Na2CO3) obtida dessa reação, admitindo-se um rendimento da reação de 80%, será de:
Dados:
Massas atômicas: C=12u; O=16u; Na=23u; Cl=35,5u; Ca=40u
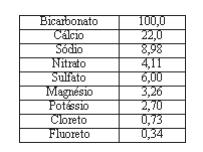
Sabe-se que a massa molar do íon sulfato (SO4 2- ) é de 96 g/mol. A quantidade de mols de íons sulfato contida em 16 L dessa água mineral é: