Questões Militares
Sobre representação das transformações químicas em química
Foram encontradas 289 questões
Dado: R = 8,314kPa dm3 mol -1 K -1
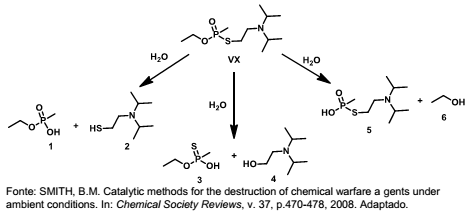
O quadro abaixo mostra as condições para detoxificação do agente VX e respectivos resultados pelos diferentes métodos.
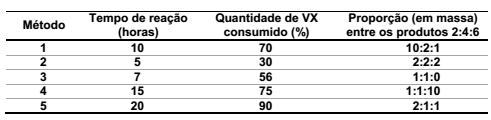
Com base nas informações fornecidas, qual método de detoxificação é mais eficiente?
O ácido carboxílico presente em maior quantidade na amostra analisada é o:

Um grupo de amigos percebe que, ao se gotejar um líquido sobre uma moeda, forma-se uma gota sobre essa moeda. Após adições sucessivas, a gota colapsa e o líquido espalha-se sobre a moeda. No entanto, eles verificam que, dependendo do líquido, o comportamento é diferente, mas o material da moeda não influencia. Assim, eles fazem um desafio para ver quem consegue utilizar o menor volume de líquido para cobrir toda a superfície da moeda, sendo que eles podem escolher entre os líquidos A, B e C e utilizar uma moeda de 5 ou 10 centavos.
Quem ganhou o desafio?
Considere as entalpias padrão de formação dos seguintes compostos:

Sabendo que a capacidade calorífica da água, à pressão constante, vale 75,9 J·mol-1 e que sua entalpia de vaporização é igual a 40,66 kJ·mol−1, assinale a alternativa que melhor corresponda ao número de mols de metano necessários para vaporizar 1 L de água pura, cuja temperatura inicial é 25°C, ao nível do mar.
(Massa molar: Mg = 24,31 g/mol)
2 MnO2 + 4 KOH + O2 → 2 K2 MnO4 + 2 H2 O.
Para o preparo de 2 Moles de manganato de potássio (K 2MnO4 ) é necessária uma massa de dióxido de manganês (MnO2) igual a:
Dados: (MnO2 = 87 g/mol).
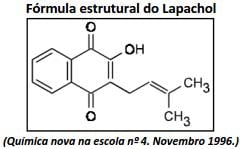
A partir da fórmula estrutural do lapachol, analise as afirmativas.
I. Possui massa molar de, aproximadamente, 242 g/mol.
II. Possui fórmula molecular C15H14O3.
III. Possui em sua estrutura as funções orgânicas fenol e éster.
Está(ão) correta(s) apenas a(s) afirmativa(s)

O cheiro característico de “fósforo queimado” se deve ao dióxido de enxofre formado.
Dados: No palito de fósforo, os componentes estão em quantidades estequiométricas. M (g mol-1 ): Cl = 35,5; K = 39; O= 16; P = 31; S = 32.
A massa (em g) de dióxido de enxofre produzido ao queimar uma cabeça de fósforo é aproximadamente:
Observe a reação a seguir.
H2C2O4(aq) + 2OH- (aq) → C2O4- (aq) + 2H2O(I)
Suponha que um técnico em química dissolva em água uma
amostra de 1,0g de ácido oxálico impuro e adicione algumas
gotas de indicador ácido-base. Em seguida, ele titula a
solução com NaOH 0,5M. A amostra consome 40mL da solução de
NaOH até atingir o ponto de equivalência. Qual é a massa de
ácido oxálico na amostra inicial?