Questões Militares
Sobre representação das transformações químicas em química
Foram encontradas 288 questões
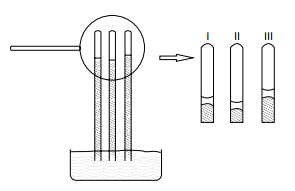
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
No trecho “Quando estou com a água, não guardo mágoa. Explodo de emoção”, o autor descreve a maneira altamente energética com que sódio metálico reage com água, conforme equação a seguir:
a Na(s) + b H2O(l) c NaOH(aq) + d H2(g)
Na equação balanceada, os valores dos coeficientes estequiométricos a, b, c e d são, respectivamente:
O ânion perxenato (XeO6 4- ) é um oxidante muito forte, capaz de oxidar Mn(II) a Mn(VII), conforme a equação química abaixo:
5 Na4XeO6(aq) + 8 MnSO4(aq) + 2 H2O(l) → 5 Xe(g) + 8 NaMnO4(aq) + 6 Na2SO4(aq) + 2 H2SO4(aq)
Além disso, o XeO6 4- é um oxidante limpo, pois não introduz produtos de redução no meio da reação, uma vez que o xenônio formado está na forma de gás.
Um experimento foi realizado na temperatura de 300 K e 100 kPa, em que 16 mol de MnSO4 foram totalmente oxidados por Na4XeO6 e todo o gás produzido foi coletado. Nessas condições, o volume de um mol de um gás ideal é igual a 24,9 L.
O volume (em L) de gás coletado nesse experimento foi igual a:
O fósforo branco, substância química cuja estrutura é representada pela fórmula P4 , é utilizado em algumas munições fumígenas (munições que produzem fumaça). Ele pode ser obtido a partir da fosforita (Ca3(PO4)2), um mineral de fosfato de cálcio, por meio da reação com sílica (dióxido de silício - SiO2) e carvão coque (C) num forno especial a 1300 ºC.
A equação não balanceada da reação é:
Ca3(PO4)2 (s) + SiO2 (s) + C (s) → CaSiO3 (s) + CO (g) + P4 (s)
Acerca deste processo, são feitas as seguintes afirmativas:
I – Após o balanceamento da equação por oxidorredução, a soma dos coeficientes estequiométricos é igual a 35.
II – O dióxido de silício é uma molécula que apresenta estrutura de geometria molecular angular.
III – O agente redutor do processo é o dióxido de silício.
IV – Neste processo ocorre a oxidação do carbono.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Um analista químico realizou um experimento em que utilizou 200 mL de uma solução de concentração 2 mol/L de ácido clorídrico (HCl) para reagir com uma certa massa de bicarbonato de sódio (também denominado de hidrogenocarbonato de sódio). Notou que nem todo o ácido reagiu com essa massa de bicarbonato de sódio, restando um excesso de ácido. Ao final do experimento, ele obteve um volume de 6,15 L de gás carbônico, medidos a 27 ºC e 1 atm. Esse gás carbônico é oriundo da decomposição do ácido carbônico produzido na reação.
Dados: R = 0,082 atm·L·mol-1·K-1
T (Kelvin) = t (Celsius) + 273
Esse analista fez as seguintes afirmativas:
I – A equação química balanceada que descreve corretamente a reação citada é:
Na2CO3 + 2 HCl → H2CO3 + 2 NaCl
II – Para a formação de 6,15 L de CO2, foram consumidos 21 g de bicarbonato de sódio.
III – É uma reação de oxidorredução e o ácido clorídrico é o agente oxidante.
IV – Se todo esse ácido clorídrico fosse consumido numa reação completa com bicarbonato de sódio suficiente, o volume de gás carbônico produzido seria de 9,84 L.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
Devido ao intenso calor liberado, reações de termita são bastante utilizadas em aplicações militares como granadas incendiárias ou em atividades civis como solda de trilhos de trem. A reação de termita mais comum é a aluminotérmica, que utiliza como reagentes o alumínio metálico e o óxido de ferro III.
A reação de termita aluminotérmica pode ser representada pela equação química não balanceada:
Al (s) + Fe2O3 (s) → Fe (s) + Al2O3 (s) + Calor
Dados: valores arredondados de entalpias padrão de formação das espécies ∆Ho fAl2O3 = - 1676 kJ/ mol; ∆Ho f Fe2O3 = - 826 kJ/mol
Acerca desse processo, são feitas as seguintes afirmativas:
I – Após correto balanceamento, o coeficiente do reagente alumínio na equação química é 2.
II – Essa é uma reação de oxidorredução e o agente oxidante é o óxido de ferro III.
III – Na condição padrão, o ∆H da reação é - 503 kJ para cada mol de óxido de alumínio produzido.
IV – Na condição padrão, para a obtenção de 56 g de ferro metálico, o calor liberado na reação é de 355 kJ.
Assinale a alternativa que apresenta todas as afirmativas corretas, dentre as listadas acima.
A combustão completa do eicosano, um dos componentes da parafina utilizada para formar velas, é representada pela seguinte equação, não balanceada:
___ C20H42 + ___ O2 → ___ CO2 + ___H2O
Nessa equação, quando o coeficiente estequiométrico do
eicosano for 2, o do oxigênio será
A sim-trimetilenotrinitramina (C3 H6 N6 O6 ), também conhecida como RDX ou ciclonita, é um poderoso explosivo utilizado na fabricação de minas, cargas de profundidade e em torpedos, entre outros.
Sua estrutura química é apresentada a seguir.
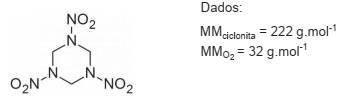
A detonação de um explosivo é uma reação de oxidação, provocada por impacto ou por ação do calor. Quando a quantidade de oxigênio presente na molécula do explosivo é insuficiente para que a oxidação completa ocorra, parte do oxigênio provém de fontes externas, como o ar atmosférico. O balanço de oxigênio para a molécula de explosivo fornece a fração de oxigênio, em percentual mássico, insuficiente ou excedente, que a molécula apresenta relativamente à quantidade necessária para a sua oxidação completa.
No caso da ciclonita, esse percentual é de
Com o avanço crescente da violência nas grandes cidades, o uso de armas não letais pelas polícias e forças armadas, no intuito de dispersar ou controlar multidões em protestos ou manifestações violentas, vem crescendo cada vez mais no Brasil. Entre essas armas, os compostos lacrimogêneos destacam-se como um poderoso agente, provocando irritação nos olhos, acompanhada por lacrimação, assim como irritações na pele e nas vias respiratórias. Os lacrimogêneos são constituídos de três compostos que são utilizados separadamente: o cloroacetofenona (CN), o 2-clorobenilideno malononitrila (CS) e dibenz-1:4-oxazepina (CR).
A seguir estão representadas as estruturas desses três compostos:
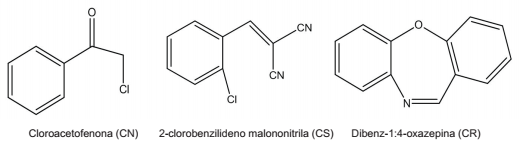
Sobre esses compostos, foram feitas as seguintes afirmativas:
I. Um mol de molécula do composto CN tem 5 pares de elétrons não ligantes.
II. Um mol de molécula do composto CS tem 4 ligações pi.
III. Um mol de molécula do composto CR tem 9 mols de átomos de hidrogênio.
IV. Somente o composto CS tem mais de um carbono primário.
Estão corretas as afirmativas
O módulo de descida lunar da Apoio utilizou a dimetil-hidrazina (CH3)2NNH2 como combustível juntamente com o N2O4 líquido como oxidante. A reação química entre os dois reagentes no motor do foguete ocorre conforme descrito na equação química balanceada a seguir:
(CH3)2NNH2 + 2N2O4 → 4H2O + 2CO2 + 3N2
Na figura abaixo, "MO” representa um óxido de um elemento do Grupo 2 da Tabela Periódica. Assinale a opção que identifica corretamente os elementos “A”, “B”, “C" e "D”, respectivamente.
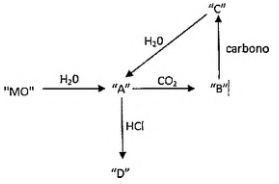
A fórmula mínima desse óxido é:
Dados: massa atômica de cobre 64 u ; volume molar nas CNTP: 22,7 L

I – O agente oxidante dessa reação é o O2.
II – O coeficiente estequiométrico da água, após o balanceamento da equação, é 2.
III – Considerando a densidade do etanol 0,8 g/mL (25 ºC; 1 atm), a combustão completa de 1150 mL desse composto libera aproximadamente 27360 kJ.
IV – A quantidade de calor liberada na combustão de 1 mol de etanol é de 278 kJ·mol-1.
Das afirmativas feitas estão corretas apenas
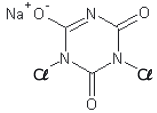
dicloro isocianurato de sódio
Considerando a estrutura apresentada e o texto, são feitas as seguintes afirmativas:
I – em sua estrutura encontra-se o grupo funcional representativo da função nitrocomposto. II – todos os carbonos apresentados na estrutura possuem hibridização sp2. III – sua fórmula molecular é C3Cl2N3NaO3. IV – Considerando-se um cantil operacional contendo 1000 mL de água, será necessário mais que uma unidade do comprimido para desinfecção completa dessa água.
Das afirmativas feitas estão corretas apenas:
(FONSECA, Martha Reis Marques da, Química Geral, São Paulo: Ed FTD, 2007, pág 330)
O carbeto de cálcio (CaC2), também denominado de carbureto ou acetileto de cálcio, é um sólido duro que reage com a água para produção do gás acetileno (C2H2). A reação que se processa é representada pela seguinte equação não balanceada: CaC2 + H2O C2H2 + Ca(OH)2
Com relação a esta reação, seus reagentes e produtos, são feitas as seguintes afirmativas:
I – o carbeto de cálcio é um composto iônico. II – a nomenclatura oficial da União Internacional de Química Pura e Aplicada (IUPAC) para o acetileno (C2H2) é etino. III – o Ca(OH)2 é classificado como uma base de Arrhenius e tem nomenclatura de hidróxido de cálcio. IV – a soma dos coeficientes da equação corretamente balanceada é 5. V – todos os reagentes e produtos são classificados como substâncias simples.
Dado: número atômico (Z) H = 1; O = 8; Ca = 20; C = 6
Estão corretas apenas as afirmativas
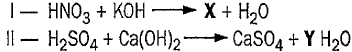
Considere as seguintes equações de neutralização total representadas abaixo.
A maior parte da produção de amônia, nos dias atuais, é utilizada para a produção de fertilizantes. Esse processo é conhecido como Haber-Bosch. Parte de nitrogênio (N2) e Hidrogênio (H2) formando a amônia (NH3). A reação é executada entre 400 e 450° C e 600 atm (atmosferas) e pode ser representada pela equação abaixo.
______ N2(g) + ______ H2(g) ⇔ ______ NH3(g)
Assinale a alternativa que completa correta e respectivamente as lacunas nos balanceamentos da reação acima.