Questões Militares
Sobre representação das transformações químicas em química
Foram encontradas 288 questões
Conforme descrito pelo Corpo de Bombeiros Militar de Minas Gerais, um incêndio destruiu parte de uma casa no norte do estado de Minas Gerais. O acidente ocorreu quando uma criança de 4 anos brincava com uma caixinha de fósforos.
Disponível em: https://www.otempo.com.br/cidades/paisdeixam-crianca-de-4-anos-brincar-com-fosforo-e-casa-eincendiada-em-mg-1.2430627. Acesso em: 3 ago. 2021
(adaptado).
Na ponta do palito de fósforos existem várias substâncias, entre elas o trissulfeto de tetrafósforo (P4 S3 ). Essa substância inflama-se na presença de oxigênio, conforme descrito na equação química não balanceada a seguir:
P4 S3(s) + O2(g) → P4O10(s) + SO2(g)
Considerando que um palito de fósforo é constituído por 1.000 mg dessa substância, que por sua vez possui 40% em massa de trissulfeto de tetrafósforo, qual é a massa mais próxima do gás dióxido de enxofre (SO2 ), produzida quando um palito de fósforo se queima completamente?
Uma das ações do Corpo de Bombeiros Militar é orientar os banhistas de rios e lagoas quanto aos riscos de nadarem alcoolizados. Esses banhistas estão sujeitos ao afogamento, pois, ao consumirem álcool, ficam com a coordenação motora comprometida e perdem a percepção do perigo. Para ficar embriagada, uma pessoa que pesa 70 kg precisa ingerir 15 mL de etanol puro, que se acumula na corrente sanguínea, deixando-a sujeita ao afogamento.
Com base nas condições descritas e considerando que o teor alcoólico de uma cerveja seja de 5% V/V, qual quantidade mínima dessa bebida, em mililitros, ingerida por um indivíduo, poderia caracterizar sua embriaguez?
Leia os textos a seguir e resolva a questão:
“Nas equações químicas, tanto as substâncias transformadas (reagentes) como as produzidas são representadas por fórmulas. As fórmulas das substâncias indicam elementos que as constituem e, também, a quantidade de átomos de cada elemento. O número que indica essa quantidade de átomos é chamado índice, que é anotado à direita do símbolo de cada elemento. (...)
A quantidade de cada substância que participa da reação é indicada por números escritos antes de suas fórmulas, denominados coeficientes estequiométricos, que devem ser os menores números inteiros possíveis.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 1: Química Geral. p. 385.
“Em uma reação de oxidorredução, o mais comum é que uma espécie se oxide e outra se reduza. Porém, podem ocorrer casos com duas ou mais oxidações e apenas uma redução ou viceversa. De qualquer maneira, para o balanceamento desse tipo de reação, o princípio é sempre o mesmo: n° de elétrons perdidos = n° de elétrons recebidos.”
Fonte: USBERCO, João e SALVADOR, Edgard. Química. 14ª ed. Reform - São Paulo: Editora Saraiva, 2009. v. 2: Físico-Química. p. 250.
Considere a seguinte equação de reação química de oxidorredução não balanceada:
As2S3 + NH4OH + H2O2 → (NH4)3AsO4 + (NH4)2SO4 + H2O
Acerca desta reação química de oxidorredução e de suas espécies, são feitas as seguintes afirmativas:
I – O peróxido de hidrogênio é o agente redutor.
II – Após o devido balanceamento, o coeficiente estequiométrico da água é 20.
III – O arsênio da substância As2S3 é reduzido, enquanto o enxofre é oxidado.
IV – O (NH4)2SO4 é um sal cujo nome é sulfito de amônio.
V – Após o devido balanceamento, a soma de todos os coeficientes estequiométricos da equação é igual a 52.
Das afirmativas feitas, estão corretas apenas
Sabendo-se que 1 mol de Ag contém 6,022 x 1023 átomos de Ag e pesa 107,9g, qual é a massa, em gramas, de um átomo de prata?
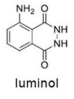
Tendo como referência a estrutura do luminol, apresentada anteriormente, e as informações do texto precedente, julgue o item a seguir, considerando que MH = 1 g/mol, MC = 12 g/mol, MN = 14 g/mol e MO = 16 g/mol.
Em 2 mols de moléculas de luminol, existem 14 × 1023
átomos de hidrogênio.
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Considere que a obtenção do NH4H2PO4 se dê pela reação do
ácido fosfórico (H3PO4) com a amônia (NH3) em uma reação
com 100% de rendimento. Nesse caso, para a obtenção de
120 kg de NH4H2PO4, são necessários menos de 100 kg de
ácido fosfórico.
Uma mistura de carbonato de sódio decahidratado e bicarbonato de sódio foi colocada em um cadinho e levada a uma mufla a 350 °C por 3 h, tendo ocorrido as seguintes reações.
Na2CO3 · 10 H2O(s) → Na2CO3(s) + 10 H2O(v)
2 NaHCO3(s) → Na2CO3(s) + H2O(v) + CO2(g)
Finalizado o processo, restou unicamente carbonato de
sódio no cadinho, verificando-se uma perda total de massa de
6,70 g.
Sabendo que M(H) = 1 g/mol, M(C) = 12 g/mol,
M(O) = 16 g/mol e M(Na) = 23 g/mol, e supondo que a
quantidade de CO2 seco desprendido do cadinho seja igual a
2,20 g, assinale a opção que indica a quantidade, em gramas, de
Na2CO3 · 10 H2O existente na mistura inicial.
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Com base nessa figura e sabendo que a massa inicial corresponde a 100%, é ERRADO afirmar que
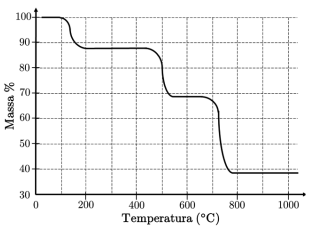
A decomposição térmica do oxalato de cálcio anidro inicia em cerca de 400 ºC e ocorre em duas etapas representadas pelas equações. O composto sólido formado na primeira reação se decompõe em cerca de 600 o C.
CaC2O4 (s) → CaCO3 (s) + CO (g) CaCO3 (s) → CaO (s) + CO2 (g)
O resultado da análise é apresentado na forma de uma curva da variação de massa em função da temperatura ao longo do processo de aquecimento.
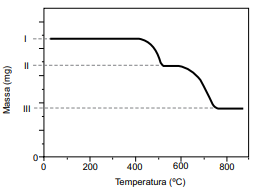
(Cavalheir, E. T. G.; et al. Química Nova. Adaptado)
I. 51,2 mg da amostra da mistura de CaC2O4 e SiO2. II. 42,8 mg. III. 29,6 mg.
O teor de oxalato de cálcio nessa amostra é de
Uma reação que pode ocorrer com a pólvora é 2 KNO3 + S + 3 C → K2S + N2 + 3 CO2 Em uma reação completa, foram obtidos 135 kg de produtos, a partir da queima de 101 kg de nitrato de potássio e 16 kg de enxofre. A quantidade de carvão queimada, em quilogramas, foi de
Com os problemas de natureza sanitária causados pela pandemia gerada pela Covid-19, o Corpo de Bombeiros Militar de Minas Gerais tem realizado ações que visam orientar a população quanto ao uso do álcool em gel 70 ºINPM (grau INPM – Instituto Nacional de Pesos e Medidas) ou (70% p/p). O fato é que o álcool em gel se tornou um poderoso combatente no processo de higienização das mãos e proteção contra o novo coronavírus. Entretanto, não se deve nos esquecer de que, além de um eficiente desinfetante, o álcool é uma substância inflamável. Ele também tem sido a causa de muitos acidentes domésticos devido ao seu uso inadequado.
A equação a seguir representa a combustão de um mol de molécula do etanol:
CH3CH2OH + 3O2 → 2 CO2 + 3 H2O
ΔH° = - 1373kJ
O etanol é o tipo de álcool utilizado no álcool em gel.
Se considerar apenas o álcool 70 ºINPM como
constituinte do álcool em gel e que 460 g desse composto
foram completamente queimados, qual a energia, em kJ,
mais próxima liberada nesse processo?
CAMPOS, B. Instituto Geral de Perícias de Santa Catarina. Disponível em: <https://www.sc.gov.br/noticias/temas/defesa civil-e-bombeiros/perito-do-igp-explica-semelhancas-entreexplosao -em-beirute-e-incidente-em-sao-francisco-do-sul>. Acesso em: 20 ago. 2020 (Adaptação).
Considerando que 20 toneladas do fertilizante com 65%m/m em nitrato de amônio foram expostas ao acidente e todo o nitrato foi queimado, qual é a massa mais próxima, em toneladas, de nitrogênio, detonada na explosão?
O carbeto de cálcio, de fórmula CaC2 , é muito comum em equipamentos usados por exploradores de cavernas para fins de iluminação. Ele reage com água e gera como um dos produtos o gás acetileno (etino), de fórmula C2H2, conforme mostra a equação, não balanceada, a seguir
CaC2 (s) + H2O (l) → C2H2 (g) + Ca(OH)2 (s) (equação 1)
Sequencialmente, esse gás inflamável pode sofrer uma reação de combustão completa, liberando intensa energia, conforme a equação, não balanceada, a seguir
C2H2 (g) + O2 (g) → CO2 (g) + H2O (g) + calor (equação 2)
Uma massa de 512 g de carbeto de cálcio com pureza de 50% (e 50% de materiais inertes) é tratada com água, obtendo-se uma certa quantidade de gás acetileno. Esse gás produzido sofre uma reação de combustão completa.
Considerando a reação de combustão completa do acetileno nas condições ambientes (25ºC e 1 atm), o volume de gases obtidos e o valor da energia liberada como calor nessa reação, a partir da massa original de carbeto de cálcio, são, respectivamente,
Dados:
– volume molar na condição ambiente = 24,5 L · mol-1 (25ºC e 1 atm); calor de combustão do etino = -1298 kJ · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
O fósforo branco, de fórmula P4, é uma substância bastante tóxica. É utilizado para fins bélicos como arma química de guerra em granadas fumígenas. Pode ser obtido a partir do aquecimento do fosfato de cálcio, areia e coque em um forno especial, conforme mostrado na equação balanceada da reação:
2 Ca3(PO4)2 (s) + 6 SiO2 (s) + 10 C (s) → 6 CaSiO3 (s) + 1 P4 (s) + 10 CO (g)
A respeito da reação de obtenção do fósforo branco, seus participantes e suas características são feitas as seguintes afirmativas.
I – O fósforo branco é classificado como uma substância iônica polar.
II – O fósforo branco (P4 ) é classificado como uma substância simples.
III – A geometria da molécula do gás monóxido de carbono é angular.
IV – A massa de fósforo branco obtida quando se aquece 1860 g de fosfato de cálcio com rendimento de 80% é de 297,6 g.
V – A distribuição eletrônica do átomo de cálcio no estado fundamental é: 1s2 2s2 2p6 3s2 3p5.
Das afirmativas feitas estão corretas apenas
O oxalato de cálcio é oxidado por permanganato de potássio em meio ácido. A equação não balanceada dessa reação é representada a seguir:
CaC2O4 + KMnO4 + H2SO4 → CaSO4 + K2SO4 + MnO2 + H2O + CO2
A soma dos coeficientes da equação da reação corretamente balanceada (menores números inteiros) e o volume de CO2 liberado quando se faz reagir 384 g de oxalato de cálcio por reação completa, na condição ambiente (25 ºC e 1 atm), são, respectivamente
Dados:
– volume molar nas condições ambiente de temperatura e pressão (25 ºC e 1 atm): 24,5 L · mol-1 ; e
– constante universal dos gases R=0,082 L · atm · mol-1 · K-1 .
Em química orgânica existem várias apresentações de fórmulas, como fórmulas moleculares e percentuais. A fórmula molecular indica o número de átomos de cada elemento em uma molécula da substância. A fórmula percentual indica a porcentagem, em massa, de cada elemento que constitui a substância. Uma maneira de determinação dessa fórmula é a partir da fórmula molecular, aplicando-se conceitos de massa atômica e massa molecular.
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 114
Tratando-se da estrutura e fórmula molecular, aldeídos são substâncias orgânicas que apresentam em sua estrutura o grupo carbonila ligado a um átomo de hidrogênio, na ponta de uma cadeia carbônica.
Considere os seguintes aldeídos: metanal; etanal; propanal; 3-metilbutanal e 2-metilbutanal.
Baseado nas fórmulas moleculares dos compostos citados, o aldeído que apresenta, em sua
fórmula percentual, aproximadamente 54,5 % em massa de carbono (C) na sua estrutura é o
O texto a seguir é referência para a questão.
Na Onda do Sódio
Eu sou o Sódio,
não tenho ódio.
Quando estou com a água,
não guardo mágoa.
Explodo de emoção,
nessa reação.
Não esbanjo meu potencial,
sou muito legal.
Minha família é a um,
me dou bem com cada um.
Meu período é o terceiro,
de quem eu sou parceiro.
a Na(s) + b H2O(I) → c NaOH(aq) + d H2(g)
Na equação balanceada, os valores dos coeficientes estequiométricos a, b, c e d são, respectivamente:
O desenho abaixo ilustra como ocorre uma transformação química em que a espécie A (esferas cinzas) reage com a espécie B (esferas pretas), de modo a formar uma nova substância.
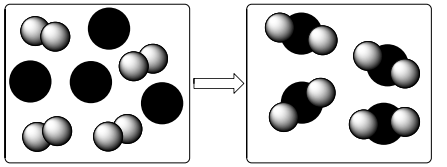
Qual é a equação química que descreve de maneira correta a reação que está esquematizada no desenho?
CaC2O4 (s) ➝ CaCO3 (s) + CO (g) CaCO3 (s) ➝ CaO (s) + CO2 (g)
O resultado da análise é apresentado na forma de uma curva da variação de massa em função da temperatura ao longo do processo de aquecimento.
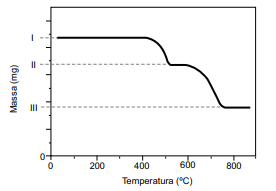
(Cavalheir, E. T. G.; et al. Química Nova. Adaptado)
I. 51,2 mg da amostra da mistura de CaC2 O4 e SiO2 . II. 42,8 mg. III. 29,6 mg.
O teor de oxalato de cálcio nessa amostra é de
Considerando que a reação cessa após o consumo total do reagente limitante, ao serem misturados 12 mol de cada um dos reagentes, a quantidade máxima de fosfeto de boro que pode ser formada e a quantidade total de reagentes que permanecem sem reagir são, respectivamente,