Questões Militares
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 113 questões
II. Ao borbulhar gás cloro em uma solução aquosa e incolor de brometo de sódio, a solução se tornará ligeiramente marrom.
III. Ao adicionar uma solução aquosa de iodeto de sódio a uma solução aquosa de cloreto de potássio, haverá a formação de um gás.
IV. Ao adicionar bromo líquido a uma solução aquosa de fluoreto de sódio, haverá formação de um gás.
V. Ao adicionar bromo líquido a uma solução aquosa de iodeto de sódio, haverá formação de um sólido.
Das afirmações acima, estão CORRETAS
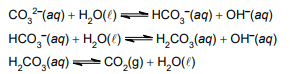
A solução tampão formada nesse sistema envolve o par conjugado ácido-base, nessa ordem:
De acordo com os dados do enunciado, os volumes, em mL, de etanol e de água existentes em 15L da solução de etanol usada para a higienização, são, respectivamente
Massa molar: Na=23 g/mol; H=1 g/mol; O=16 g/mol.
Para um experimento sobre o estudo das propriedades de coloides, foram aquecidos 50 mL de água destilada até a ebulição e adicionadas 30 gotas de solução aquosa de cloreto de ferro (III) 1 mol/L. Após resfriada, essa mistura foi transferida para um saquinho constituído de uma membrana semipermeável, e esse saquinho foi selado nas duas extremidades e colocado no interior de um béquer contendo água destilada na temperatura ambiente, conforme representado na figura a seguir.
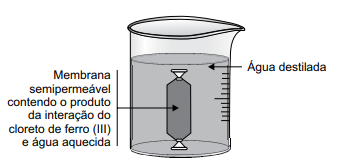
Após 30 minutos, foram coletadas três amostras do líquido do béquer, de 2 mL cada, e colocadas em três tubos de ensaio, com os quais foram realizados os seguintes testes.
Tubo 1 – caráter acido-base: adição de 5 gotas de solução de indicador azul de bromotimol.
Tubo 2 – presença de íons cloreto: adição de 2 gotas de solução de ácido nítrico 0,1 mol/L e 5 gotas de solução de nitrato de prata, 0,1 mol/L.
Tubo 3 – presença de íons ferro (III): adição de 20 gotas de solução de tiocianato de amônio 0,5 mol/L.
Dados de coloração do indicador azul de bromotimol:
pH < 6.4 cor amarela;
6,4 < pH < 7,6 cor verde;
pH > 7,6 cor azul.
Os testes dos tubos I, II e III apresentaram, correta e respectivamente, os resultados:
Uma solução saturada de brometo de amônio foi preparada usando-se 49,0 g de H2 O a 50 ºC. Essa solução foi transferida quantitativamente para um balão volumétrico e foi adicionada água destilada, até atingir a capacidade volumétrica do balão, que era de 250 mL. O gráfico a seguir apresenta a curva de solubilidade do brometo de amônio.
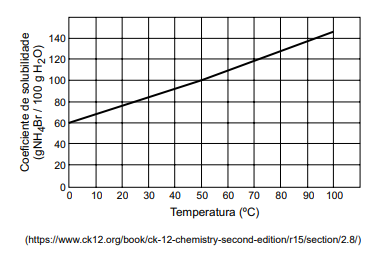
A concentração molar dessa solução é igual a, aproximadamente,

Uma amostra de 2 mL da água de um rio foi misturada com 8 mL de água pura (destilada) de modo a produzir 10 mL de solução. Essa solução foi submetida ao teste com azul de molibdênio que forneceu o resultado de intensidade de cor igual a 3 unidades arbitrárias. O valor de concentração de fosfato na água desse rio é mais próximo de:
Para preparar uma solução aquosa de NaNO3, um técnico de laboratório utilizou 17g desse sal, transferiu para um balão de 500 mL e completou o seu volume com água. A solução por ele obtida apresenta a concentração molar de
Dados: MM (NANO3): 85 g/mol

I. Água e metanol.
II. Acetona e dissulfeto de carbono.
III. Acetona e clorofórmio.
IV. n-hexano e n-heptano. V. Metanol e etanol.
Assinale a alternativa que apresenta os pares de substâncias que formam soluções consideradas ideais.
Sabe-se que a soda cáustica é o nome usual do hidróxido de sódio (NaOH), que é comercializada no estado sólido no qual, em alguns produtos disponíveis, o grau de pureza é cerca de 90% em massa. No laboratório, quando se deseja neutralizar 10 g de soda cáustica, são necessários 100 mililitros de solução de ácido clorídrico (HCl).
Com base nessas informações, qual é a concentração, em mol/L, do ácido clorídrico necessária para neutralizar completamente a soda cáustica?
Uma das ações do Corpo de Bombeiros Militar é orientar os banhistas de rios e lagoas quanto aos riscos de nadarem alcoolizados. Esses banhistas estão sujeitos ao afogamento, pois, ao consumirem álcool, ficam com a coordenação motora comprometida e perdem a percepção do perigo. Para ficar embriagada, uma pessoa que pesa 70 kg precisa ingerir 15 mL de etanol puro, que se acumula na corrente sanguínea, deixando-a sujeita ao afogamento.
Com base nas condições descritas e considerando que o teor alcoólico de uma cerveja seja de 5% V/V, qual quantidade mínima dessa bebida, em mililitros, ingerida por um indivíduo, poderia caracterizar sua embriaguez?
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“ Batalhão realiza marcha a pé de 8 k m, como atividade
do Programa de Instrução de 2021
Aquidauana (MS) – No dia 11 de março, o 9º Batalhão de Engenharia de Combate (9º BE Cmb), Batalhão Carlos Camisão, seguindo o cronograma de Instrução de 2021, realizou a marcha a pé de 8 km. A atividade teve por finalidade desenvolver a rigidez, disciplina no deslocamento a pé, capacitação profissional e manutenção da operacionalidade da tropa.”
Fonte: https://www.eb.mil.br/web/noticias/noticiario-do-exercito. Acessado em 16 MAR 21.
Atividades físicas intensas promovem a perda de água e de eletrólitos. Para repor essas perdas, soldados podem consumir um repositor hidroeletrolítico durante a atividade de campanha. Esses repositores são constituídos de uma solução aquosa contendo várias substâncias químicas, principalmente sais.
Considere um repositor que possua as seguintes especificações: cada porção de 200 mL contém 90 mg de íons sódio, 24 mg de íons potássio e 84 mg de íons cloreto.
Baseado nestas informações, são feitas as seguintes afirmativas:
I) A concentração de íons sódio na solução é de 0,45 g L-1 .
II) Cada litro do repositor possui aproximadamente 3,1 x 10-3 mol de íons potássio.
III) A temperatura de congelamento de uma porção de repositor é maior do que a temperatura de congelamento da água pura nas mesmas condições.
IV) Para se obter 0,2 mol de íons cloreto, seriam necessários aproximadamente 100 litros de repositor.
Das afirmativas feitas, estão corretas apenas
Qual é a concentração, em mol, da solução de NaOH?
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Em uma solução de NH4H2PO4, de concentração 12,0 g/L, a
concentração em quantidade de matéria do elemento fósforo
é maior que 0,1 mol/L.