Questões Militares
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 114 questões
Coloque F (falso) ou V (verdadeiro), nas afirmativas abaixo, assinalando a seguir a opção correta.
( ) Na formação de um precipitado, é necessário considerar as etapas de nucleação e o crescimento dos cristais.
( ) Segundo a equação de Von Weimarn, quanto maior a concentração dos reagentes, maior o grau de dispersão e menor o tamanho das partículas.
( ) Precipitados formados por aglomeração coloidal são amorfos e porosos, com enormes áreas superficiais.
( ) É comum, nos procedimentos gravimétricos, deixar o precipitado repousar na presença da água mãe, durante um determinado tempo, antes de ser filtrado.
Uma amostra de 5 g de hidróxido de sódio (NaOH) impuro foi dissolvida em água suficiente para formar 1 L de solução.
Uma alíquota de 10 mL dessa solução aquosa consumiu, numa titulação, 20 mL de solução aquosa de ácido clorídrico (HCl) de concentração igual 0,05 mol·L-1.
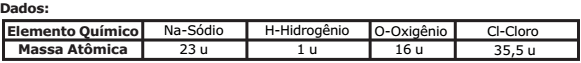
Admitindo-se que as impurezas do NaOH não reagiram com nenhuma substância presente
no meio reacional, o grau de pureza, em porcentagem, de NaOH na amostra é
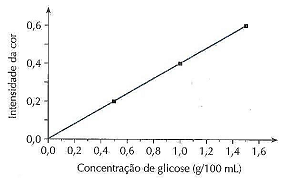
“Uma amostra de urina, submetida ao tratamento anterior, apresentou uma intensidade de cor igual a 0,4 na escala do gráfico." Qual a concentração em mols desta amostra?
Considere as seguintes afirmações:
I. Um coloide é formado por uma fase dispersa e outra dispersante, ambas no estado gasoso.
II. As ligações químicas em cerâmicas podem ser do tipo covalente ou iônica.
III. Cristal líquido apresenta uma ou mais fases organizadas acima do ponto de fusão do sólido correspondente.
Então, das afirmações acima, está(ão) CORRETA(S)
A 25 °C, as massas específicas do etanol e da água, ambos puros, são 0,8 g cm−3 e 1,0 g cm−3 , respectivamente. Adicionando 72 g de água pura a 928 g de etanol puro, obteve-se uma solução com 1208 cm3 de volume.
Assinale a opção que expressa a concentração desta solução em graus Gay-Lussac (°GL).
Considere Y a quantidade (em mol) de iodo dissolvido em 100 mL de água, X um solvente praticamente imiscível em água e K (=120 ) a constante de partição do iodo entre o solvente X e a água a 25 0C. Assinale a alternativa CORRETA para o volume do solvente X necessário para extrair 90% do iodo contido inicialmente em 100 mL de água.
Dado: massa molar do Sulfato de Bário = 233 g/mol
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.
Com base nas informações acima e na tabela periódica, incluída no final deste caderno de provas, julgue os itens a seguir.

