Questões Militares
Sobre soluções: características, tipos de concentração, diluição, mistura, titulação e soluções coloidais. em química
Foram encontradas 114 questões
Hidrogênio - 1 Carbono - 12 Nitrogênio - 14 Oxigênio - 16 Sódio - 23 Enxofre - 32 Cloro - 35,5 Cálcio - 40
A concentração em mol · L-1 dos íons sulfato ( SO
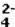 ) presentes na solução final é :
) presentes na solução final é :
Considerando que, na titulação do ácido sulfúrico formado no borbulhador, foram gastos 3,2 mol de NaOH e que o totalizador de volume indicou 4 m3 de amostra de ar, conclui-se que, nessa análise, a concentração de dióxido de enxofre no ar amostrado era de 8 × 10-4 mol / L.
O método de separação de misturas representado pelo dispositivo 2, representado na figura, também é eficaz para a separaração dos componentes da solução resultante do processo de titulação empregado na dosagem do ácido sulfúrico.
De acordo com o texto, a concentração máxima de ácido benzoico permitida em bebidas refrigerantes é superior a 40 mmol/L.
É provável que muitos alunos conheçam a clássica questão: “o que pesa mais, um quilo de chumbo ou um quilo de algodão?” Na verdade, eles têm a mesma massa, porém, os volumes que ocupam é que são diferentes.
A propriedade dessas matérias em que o
chumbo tem a sua massa contida em um
pequeno volume, enquanto o algodão tem sua
massa ocupando um grande volume, é definida
pela(o):
Considere as seguintes afirmações:
I. Um coloide é formado por uma fase dispersa e outra dispersante, ambas no estado gasoso.
II. As ligações químicas em cerâmicas podem ser do tipo covalente ou iônica.
III. Cristal líquido apresenta uma ou mais fases organizadas acima do ponto de fusão do sólido correspondente.
Então, das afirmações acima, está(ão) CORRETA(S)
A 25 °C, as massas específicas do etanol e da água, ambos puros, são 0,8 g cm−3 e 1,0 g cm−3 , respectivamente. Adicionando 72 g de água pura a 928 g de etanol puro, obteve-se uma solução com 1208 cm3 de volume.
Assinale a opção que expressa a concentração desta solução em graus Gay-Lussac (°GL).
I. Ambas as etapas 1 e 2 ocorrem com absorção de calor.
II. Se a energia da etapa 3 suplantar a soma de 1 e 2, o processo é exotérmico.
III. A etapa 3 pode ser exotérmica ou endotérmica a depender do soluto.
IV. Se a soma de 1 e 2 for maior que o módulo de 3, a dissolução libera calor.
V. Se a energia para separar as partículas do soluto for elevada, não ocorrerá a dissolução.
Bicarbonato 100,0
Cálcio 22,0
Sódio 8,98
Nitrato 4,11
Sulfato 6,00
Magnésio 3,26
Potássio 2,70
Cloreto 0,73
Fluoreto 0,34
Sabe-se que a massa molar do íon sulfato (SO42-) é de 96 g/mol. A quantidade de mols de íons sulfato contida em 16 L dessa água mineral é:


