Questões Militares
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 291 questões
Um composto tem absortividade molar de 2x103 L cm-1 mol-1 .
Qual é a concentração do composto requerida para produzir uma solução que tenha uma transmitância de 10% em uma cela de 2,5 cm?
Observe a equação abaixo.
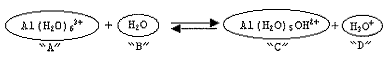
Com base na definição de ácidos e bases de Bronsted-Lowry, é
correto afirmar que os compostos acima "A", "B", "C" e "D"
são, respectivamente:
Analise as afirmativas abaixo.
I - quando Vb = ½ Ve , pH = pKa .
II - no ponto de equivalência, o pH será > 7,0
III- no ponto de equivalência, o pH será < 7,0
IV- a fenolftaleína (pH 8,0-9,6) pode ser usada como indicador.
V - o vermelho de metila (pH 4, 8-6, 0) pode ser usado como indicador.
Em relação a uma titulação de ácido acético 0,1M com
hidróxido de sódio 0,1M, é correto afirmar que:
Analise a tabela a seguir.
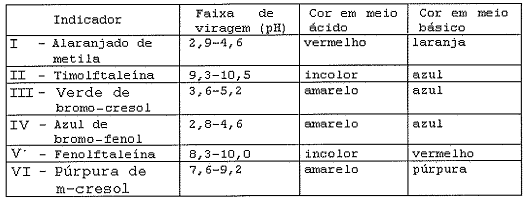
A tabela acima trata de algumas substâncias que podem ser utilizadas como indicadores de neutralização.
Que indicadores dessa tabela poderão ser utilizados para que
seja realizada a titulação de uma solução de amônia com
ácido clorídico?
Um erlenmeyer contém 10,0 mL de uma solução de ácido clorídrico, juntamente com algumas gotas de uma solução de fenolftaleína. De uma bureta, foi-se gotejando uma solução 0,100 M de hidróxido de sódio até o aparecimento de leve coloração rósea. Nesse momento, observou-se um consumo de 20,0 mL da solução alcalina. Pode-se afirmar que a concentração de HCl na solução ácida original era de:
Dados:
Massas atômicas: H = 1,00 u, O = 16,0 u, Na = 23,0 u, Cl = 35,5 u
Correlacione os métodos automatizados de titulação às suas respectivas descrições conceituais. Em seguida, assinale a opção que apresenta a sequência correta.
MÉTODO AUTOMÁTICO
I - TITULAÇÃO AMPEROMÉTRICA
II - TITULAÇÃO COULOMÉTRICA
III- TITULAÇÃO IODOMÉTRICA
IV - TITULAÇÃO POTENCIOMÉTRICA
CONCEITO
( ) Ocorre pela medida da diferença de potencial entre um eletrodo indicador e um eletrodo de referência.
( ) Ocorre pela medida da corrente que passa, sob força eletromotriz conveniente , através da célula de titulação entre um eletrodo indicador e um eletrodo de referência despolarizado.
( ) Ocorre pela revelação do titulante
por eletrólise.
I – MgO II – CO III – CO2 IV – CrO3 V – Na2O
Os óxidos que, quando dissolvidos em água pura, reagem produzindo bases são
Uma amostra de 5 g de hidróxido de sódio (NaOH) impuro foi dissolvida em água suficiente para formar 1 L de solução.
Uma alíquota de 10 mL dessa solução aquosa consumiu, numa titulação, 20 mL de solução aquosa de ácido clorídrico (HCl) de concentração igual 0,05 mol·L-1.
Admitindo-se que as impurezas do NaOH não reagiram com nenhuma substância presente
no meio reacional, o grau de pureza, em porcentagem, de NaOH na amostra é
Considere Y a quantidade (em mol) de iodo dissolvido em 100 mL de água, X um solvente praticamente imiscível em água e K (=120 ) a constante de partição do iodo entre o solvente X e a água a 25 0C. Assinale a alternativa CORRETA para o volume do solvente X necessário para extrair 90% do iodo contido inicialmente em 100 mL de água.
Em ambientes fechados, o superóxido de potássio (KO2) é utilizado em máscaras de respiração, para remover o dióxido de carbono e a água do ar exalado. A remoção de água gera oxigênio para a respiração por meio da reação
4KO2(s) + 2H2O(l) → 3O2(g) + 4KOH(s). (I)
O hidróxido de potássio remove o dióxido de carbono da máscara pela reação
KOH(s) + CO2(g) → KHCO3(s). (II)
P. W. Atkins e L. Jones. Princípios de química. Rio de Janeiro: LTC, 2006, p. 125.
Com base nas informações acima, julgue o próximo item.
A equação II representa a reação entre uma base forte e um
óxido ácido, da qual resulta o sal carbonato de potássio
Em ambientes fechados, o superóxido de potássio (KO2) é utilizado em máscaras de respiração, para remover o dióxido de carbono e a água do ar exalado. A remoção de água gera oxigênio para a respiração por meio da reação
4KO2(s) + 2H2O(l) → 3O2(g) + 4KOH(s). (I)
O hidróxido de potássio remove o dióxido de carbono da máscara pela reação
KOH(s) + CO2(g) → KHCO3(s). (II)
P. W. Atkins e L. Jones. Princípios de química. Rio de Janeiro: LTC, 2006, p. 125.
Com base nas informações acima, julgue o próximo item.
A análise da estrutura do superóxido de potássio demonstra
que ele é uma substância de natureza molecular.
Bebidas especialmente ingeridas por esportistas têm representado importante fatia de consumo. Tais bebidas são soluções isotônicas repositoras hidroeletrolíticas e, portanto, auxiliam na manutenção e preparação física de atletas de todas as modalidades. A seguir, reproduz-se parte da tabela nutricional constante no rótulo de uma dessas bebidas.

A partir dessas informações e considerando os múltiplos aspectos que
elas suscitam, julgue o item subsequente.
Os cloretos de sódio e de potássio podem ser preparados por
meio da neutralização total do ácido clórico com hidróxidos de
sódio e de potássio, respectivamente.
