Questões Militares
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 284 questões
Sabe-se que a soda cáustica é o nome usual do hidróxido de sódio (NaOH), que é comercializada no estado sólido no qual, em alguns produtos disponíveis, o grau de pureza é cerca de 90% em massa. No laboratório, quando se deseja neutralizar 10 g de soda cáustica, são necessários 100 mililitros de solução de ácido clorídrico (HCl).
Com base nessas informações, qual é a concentração, em mol/L, do ácido clorídrico necessária para neutralizar completamente a soda cáustica?
: I- Pb(NO3)2 + K2CrO4 → PbCrO4 + 2 KNO3
II- FeCl3 + 3 NaOH → Fe(OH)3 + 3 NaCl
III- BaNO3 + NaOH → Ba(OH)2 + NaNO3
IV- 2 AgNO3 + K2CrO4 → Ag2CrO4 + 2 KNO3
V- MgCl2 + 2 NaOH → Mg(OH)2 + 2 NaCl
Considerando os produtos de cada reação, somente não formará precipitado na reação:
A partir do dia 24 de março de 2021, o Primeiro Batalhão de Bombeiros Militar, em parceria com a Prefeitura de Belo Horizonte, passou a funcionar como um posto fixo para campanha de vacinação contra a Covid-19. As vacinas contra a Covid-19 foram desenvolvidas muito rapidamente e sua constituição química pode variar dependendo da vacina e do fabricante. A vacina da Pfizer, por exemplo, possui em sua constituição, dentre várias substâncias, cloreto de sódio (NaCl), dihidrogenofosfato de potássio (KH2 PO4 ), sacarose (C12H22O11) e fosfato de sódio (Na3 PO4 ).
A respeito das propriedades físico-químicas das substâncias presentes na vacina da fabricante Pfizer, assinale a alternativa correta.
Acidentes com gases tóxicos se tornam cada vez mais frequentes no Brasil. Segundo especialistas militares do Corpo de Bombeiros, o gás tóxico presente em unidades frigoríficas, indústrias de pescados e laticínios e em unidades de refrigeração industrial é o responsável por grande parte dos acidentes.
Esse gás apresenta um odor característico forte, quimicamente sua molécula é polar, e a sua estrutura contém quatro nuvens eletrônicas ao redor do átomo central, por meio da qual esse átomo apresenta um par de elétrons não ligante.
De acordo com as características da estrutura química desse composto gasoso, qual é a sua fórmula molecular?
Uma das ações do Corpo de Bombeiros Militar é orientar os banhistas de rios e lagoas quanto aos riscos de nadarem alcoolizados. Esses banhistas estão sujeitos ao afogamento, pois, ao consumirem álcool, ficam com a coordenação motora comprometida e perdem a percepção do perigo. Para ficar embriagada, uma pessoa que pesa 70 kg precisa ingerir 15 mL de etanol puro, que se acumula na corrente sanguínea, deixando-a sujeita ao afogamento.
Com base nas condições descritas e considerando que o teor alcoólico de uma cerveja seja de 5% V/V, qual quantidade mínima dessa bebida, em mililitros, ingerida por um indivíduo, poderia caracterizar sua embriaguez?
Em um experimento laboratorial, misturou-se 25 mL de uma solução aquosa de ácido clorídrico com concentração 0,8 mol L-1 com 25 mL de uma solução aquosa de hidróxido de sódio com concentração 0,6 mol L-1 .
Acerca do experimento, são feitas as seguintes afirmativas:
I – Trata-se de uma reação de neutralização.
II – A substância de caráter alcalino (básico) está em excesso estequiométrico.
III – A solução resultante após a reação possui caráter ácido.
IV – Após a reação, o pH da solução resultante possui valor igual a 2.
Das afirmativas feitas, estão corretas apenas
No estado sólido, o dióxido de carbono é conhecido como gelo seco. Em condições ambientes (25 ºC e 1 atm), ele passa do estado sólido para o estado de vapor. Acerca do dióxido de carbono, são feitas as seguintes afirmativas:
I – O dióxido de carbono é classificado como uma substância simples.
II – O dióxido de carbono é uma substância que sublima em condições ambientes.
III – A molécula do dióxido de carbono apresenta geometria angular.
IV – O dióxido de carbono é um óxido ácido que, em condições adequadas, pode reagir com água e produzir o ácido carbônico.
V – Quando se borbulha dióxido de carbono em uma solução aquosa de hidróxido de cálcio, sob condições adequadas, produz-se carbonato de cálcio e água.
VI – A hibridização do átomo de carbono na molécula do dióxido de carbono é sp2 .
Das afirmativas feitas, estão corretas apenas
Leia o texto a seguir e resolva a questão:
“ Batalhão realiza marcha a pé de 8 k m, como atividade
do Programa de Instrução de 2021
Aquidauana (MS) – No dia 11 de março, o 9º Batalhão de Engenharia de Combate (9º BE Cmb), Batalhão Carlos Camisão, seguindo o cronograma de Instrução de 2021, realizou a marcha a pé de 8 km. A atividade teve por finalidade desenvolver a rigidez, disciplina no deslocamento a pé, capacitação profissional e manutenção da operacionalidade da tropa.”
Fonte: https://www.eb.mil.br/web/noticias/noticiario-do-exercito. Acessado em 16 MAR 21.
Atividades físicas intensas promovem a perda de água e de eletrólitos. Para repor essas perdas, soldados podem consumir um repositor hidroeletrolítico durante a atividade de campanha. Esses repositores são constituídos de uma solução aquosa contendo várias substâncias químicas, principalmente sais.
Considere um repositor que possua as seguintes especificações: cada porção de 200 mL contém 90 mg de íons sódio, 24 mg de íons potássio e 84 mg de íons cloreto.
Baseado nestas informações, são feitas as seguintes afirmativas:
I) A concentração de íons sódio na solução é de 0,45 g L-1 .
II) Cada litro do repositor possui aproximadamente 3,1 x 10-3 mol de íons potássio.
III) A temperatura de congelamento de uma porção de repositor é maior do que a temperatura de congelamento da água pura nas mesmas condições.
IV) Para se obter 0,2 mol de íons cloreto, seriam necessários aproximadamente 100 litros de repositor.
Das afirmativas feitas, estão corretas apenas
Qual é a concentração, em mol, da solução de NaOH?
CLASSIFICAÇÕES (1) Ácido (2) Básico (3) Anfótero
ELEMENTOS ( ) As2O5. ( ) CaO. ( ) ZnO. ( ) Al2O3. ( ) Rb2O. ( ) BeO.
A sequência correta dessa associação é
A partir das informações do texto apresentado, julgue o item a seguir, considerando que MH = 1,00 g/mol, MN = 14,00 g/mol, MO = 16,00 g/mol, MP = 31,00 g/mol e MS = 32,00 g/mol.
Em uma solução de NH4H2PO4, de concentração 12,0 g/L, a
concentração em quantidade de matéria do elemento fósforo
é maior que 0,1 mol/L.
http://pibid-bio-uepg.blogspot.com/2013/08/as-funcoes-inorganicas-esua.html. Acesso em 09/06/2020. Adaptado.
A reação química descrita é:
AgNO3 + NaCl → AgCl + NaNO3
As substâncias X, Y e Z, descritas no texto, são denominadas, respectivamente,
Três frascos foram encontrados sem rótulo na bancada de um laboratório. Um deles continha solução de KOH a 0,1 mol/L; o outro, solução de CaCl2 a 0,05 mol/L; e o outro, solução de CH3CH2COOH a 0,1 mol/L. Na tentativa de identificar a solução contida em cada um deles, um técnico usou volumes iguais das soluções dos frascos para medir a pressão de vapor sob mesma temperatura, utilizando um sistema adequado. Os resultados obtidos estão indicados pelos ponteiros dos manômetros nesta figura.
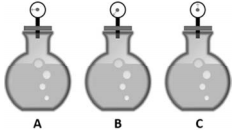
Com base nas informações e na figura apresentadas, é correto
afirmar que os frascos identificados por A, B e C contêm,
respectivamente, as soluções de
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

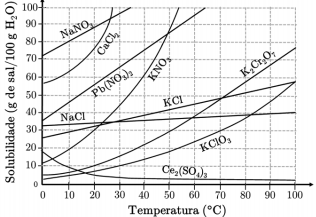
I. Dissolvendo-se 130 g de KNO3 em 200 g de água, a 40 °C, obteremos uma solução saturada com depósito de 70 g desta substância que não será dissolvida. II. Se dissolvermos 20 g de Ce2(SO4)3 em 300 g de água a 10 °C e, posteriormente, aquecermos esta solução a 90 °C, haverá gradativa precipitação da substância. III. A menor quantidade de água necessária para dissolver completamente 140 g de K2Cr2O7 a 90 °C é, aproximadamente, 150 g. IV. NaNO3 é a substância mais solúvel a 30 °C.
Das afirmações acima, está(ão) CORRETA(S)
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

(1) O volume da solução de permanganato de potássio gasto na titulação foi de 100 mL. (2) O menor coeficiente estequiométrico inteiro para Fe2+ na reação redox balanceada é 7. (3) No ponto final, o volume total da solução será de 120 mL. (4) Um precipitado sólido de cor esverdeada será observado como produto dessa reação. (5) O número total de elétrons envolvidos na reação redox é 22 milimols. (6) A razão entre os volumes do titulante e do titulado no ponto final é 2,1.
A soma dos números associados às afirmações CORRETAS é igual a
Constantes
Constante de Avogadro (NA) = 6,02 × 1023 mol−1
Constante de Faraday (F) = 9,65 × 104 C⋅mol−1 = 9,65 × 104 A⋅s⋅mol−1 = 9,65 × 104 J⋅V−1 ⋅mol−1
Carga elementar = 1,60 × 10−19 C
Constante dos gases (R) = 8,21 × 10−2 atm⋅L⋅K−1⋅mol−1 = 8,31 J⋅K −1 ⋅mol−1 = 1,98 cal⋅K−1 ⋅mol−1
Constante de Planck (h) = 6,63 × 10−34 J⋅s
Velocidade da luz no vácuo = 3,0 × 108 m⋅s −1
Número de Euler (e) = 2,72
Definições
Pressão: 1 atm = 760 mmHg = 1,01325 × 105 N⋅m−2 = 1,01325 bar
Energia: 1 J = 1 N⋅m = 1 kg⋅m2 ⋅s−2 = 6,24 × 1018 eV
Condições normais de temperatura e pressão (CNTP): 0 °C e 1 atm
Condições ambientes: 25 °C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol⋅L−1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (ℓ) = líquido. (g) = gás. (aq) = aquoso. (conc) = concentrado. (ua) = unidades arbitrárias.
u.m.a. = unidade de massa atômica. [X] = concentração da espécie química X em mol⋅L−1
ln X = 2,3 log X
EPH = eletrodo padrão de hidrogênio

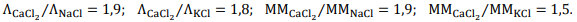
Com base nessas informações, assinale a opção CORRETA entre as condutividades das soluções.

Os coeficientes que correspondem às letras x, y e z são, respectivamente: