Questões Militares
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 291 questões
Considerando que: - a solução básica foi parcialmente neutralizada pela solução do ácido; - o ácido clorídrico é um ácido forte (α=100%); - o hidróxido de sódio é uma base forte (α=100%).
O pH da mistura resultante dessa reação de neutralização é
Dado: log 4 = 0,60
Considere as seguintes equações de neutralização total representadas abaixo.
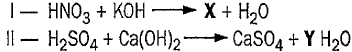
(Dado: Fe = 56 g.mol-1 ).
Sobre esses compostos químicos, assinale a alternativa CORRETA.
(Fonte: <http://istoe.com.br>.)
A notícia acima menciona as reações de outros países após o presidente dos EUA anunciar que não respeitará o acordo firmado entre 195 países para reduzir emissões de gases de efeito estufa no contexto do desenvolvimento sustentável.
O objetivo do acordo é voltado à redução na emissão principalmente do gás:
Considere a seguinte substância:

Com relação à reação abaixo, considerando a tabela acima e o pH da água igual a 7,00, assinale a opção correta.
CH3NH2(aq) + H2O(I) ⇄ CH3NH+3(aq) + OH-(aq)
Analise as reações abaixo.
NH4+ + H2O = NH3 + H3O+
[AI(H2O)4]3+ + H2O = [Al(H2O )3OH]2+ + H3O +
De acordo com a teoria de Brõnsted-Lowry, NH3 e [AI(H2O)4]3+, nas reações acima, são considerados, respectivamente:
CONSTANTES
Constante de Avogadro (NA) = 6,02 x 1023 mol-1
Constante de Faraday (F) = 9,65 x 104 C mol-1 = 9,65 x 104 A s mol-1 = 9,65 x 104 J V-1 mol-1
Volume molar de gás ideal = 22.4 L (CNTP)
Carga elementar = 1,602 x 10-19 C
Constante dos gases (R) = 8,21 x 10-2 atm L K -1 mol-1 = 8,31JK-1 mol-1 = 1,98 cal K-1 mol-1 =
= 62,4 mmHg L K-1 mol-1
Constante gravitacional (g) = 9,81 m s-2
Constante de Planck (h) = 6,626 x 10-34 m2kg s-1
Velocidade da luz no vácuo = 3,0x 108 ms-1
Número de Euler (e) = 2,72
DEFINIÇÕES
Pressão: 1 atm = 760mmHg = 1,01325 x 105 N m-2 = 760 Torr = 1,01325 bar
Energia: 1 J = 1N m = 1 kg m2 s-2
Condições normais de temperatura e pressão (CNTP): 0°C e 760 mmHg
Condições ambientes: 25° C e 1 atm
Condições padrão: 1 bar; concentração das soluções = 1 mol L-1 (rigorosamente: atividade unitária das espécies); sólido com estrutura cristalina mais estável nas condições de pressão e temperatura em questão.
(s) = sólido. (L) = líquido, (g) = gás. (aq) = aquoso. (CM) = circuito metálico, (conc) = concentrado.
(ua) = unidades arbitrárias. [X] = concentração da espécie química X em mol L-1

São feitas as seguintes proposições a respeito de propriedades coligativas:
I. A pressão osmótica depende do tipo de solvente para um dado soluto.
II. A criometria usa o abaixamento do ponto de congelamento do solvente para medir a massa molar do
soluto.
III. Na ebuliometria, a variação da temperatura de ebulição depende da concentração molal de soluto não volátil utilizado.
IV. Na tonometria, ocorre abaixamento da pressão de vapor de uma solução que contém um soluto não volátil, em relação ao solvente puro.
Das proposições acima é(são) CORRETA(S)
A pólvora é material empregado como propulsor em armas de fogo. Basicamente, a ideia é provocar uma reação que gere uma quantidade grande de gases sob pressão e temperatura elevadas. Ao se expandirem, esses gases impulsionam um projétil. A pólvora negra, empregada em armas mais antigas, é constituída por uma mistura de salitre (KNO3), enxofre (S) e material de carbono (C). A equação não balanceada de uma das reações químicas que ocorrem durante a queima da pólvora é apresentada a seguir.
KNO3 (s) + S (s) + C (s) → K2S (s) + N2 (g) + CO2 (g)
Considerando essas informações e sabendo que o número atômico do carbono é igual a 6, julgue o item que se segue.
O KNO₃ é um sal inorgânico resultante da reação de neutralização entre o hidróxido de potássio e o ácido nítrico.
Com relação a reações químicas e a substâncias, julgue o item subsequente.
A concentração de uma solução é dada pela quantidade
de matéria por litro de solução.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
Os óxidos são substâncias artificiais produzidas pela indústria.
Acerca dos diferentes tipos de ligações químicas e das substâncias formadas em reações químicas, julgue o próximo item.
O principal produto das reações de neutralização é a água.
A respeito das propriedades químicas e físicas de determinados combustíveis, julgue o próximo item.
O etanol é uma substância inorgânica.
Dadas as seguintes equações que representam supostas reações químicas irreversíveis em meio aquoso e temperaturas moderadas:
I) 6 HBr + 2 Al → 2 AlBr3 + 3 H2
II) H2SO4 + BaCl2 → BaSO4 + 2 HCl
III) 2 KOH + NiSO4 → Ni(OH)2 + K2SO4
IV) 2 HBr + K2S → 2 KBr + H2S
V) BaCl2 + Na2CO3 → BaCO3 + 2 NaCl
Pode-se afirmar que a reação:
 . L-1. Para obtenção da concentração final nessa diluição, o
volume de água destilada que deve ser adicionado é de
. L-1. Para obtenção da concentração final nessa diluição, o
volume de água destilada que deve ser adicionado é de
Na ânsia pelo "elixir da longa vida", por volta do século I, alquimistas descobriram acidentalmente a Pólvora, referenciada em textos de Alquimia pelos avisos quanto aos cuidados para não se misturarem certos materiais uns com os outros. A pólvora, mais conhecida desde o final do século XIX como pólvora negra, é uma mistura química que queima com rapidez. Foi extensamente utilizada como propelente em canhões e armas de fogo e atualmente ainda é empregada em artefatos pirotécnicos. Nitrato de potássio, enxofre e carvão (carbono) são os constituintes da pólvora negra. Sobre as espécies constituintes da pólvora negra afirma-se que
Dados:
Número Atômico: K = 19; N = 7; O = 8; S = 16; C = 6
I - o nitrato de potássio é classificado como uma base segundo a teoria de Arrhenius;
II - a 25 °C e 1 atm a variedade alotrópica mais estável do carbono é a grafite e a do enxofre é a rômbica;
III - a fórmula do nitrato de potássio é KNO2 ;
IV - o enxofre é um metal radioativo que pertence à família 6A (16) da tabela periódica;
V - o átomo de carbono (6C) estabelece 4 ligações químicas e possui a variedade alotrópica diamante, substância natural de alta dureza;
Estão corretas apenas as afirmativas