Questões Militares
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 284 questões
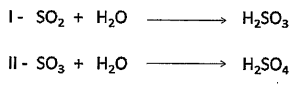
Os nomes dos ácidos formados nas reações I e lI, respectivamente, são:


A temperatura de fusão dessa solução, em ºC, corresponde aproximadamente a:


A pirita é formada por sulfeto de ferro II, cuja fórmula química corresponde a:
Em regiões industrializadas ou em grandes cidades, que possuem tráfego intenso, ocorre o fenômeno conhecido como smog fotoquímico. É como se uma forte neblina envolvesse a cidade durante o horário de maior insolação ocasionando desconforto visual.
O smog fotoquímico é resultado das reações de NO, radiação solar e NO2 com Compostos Orgânicos Voláteis, resultando na formação de aldeídos, nitrocompostos, aerossóis e oxidantes totais.
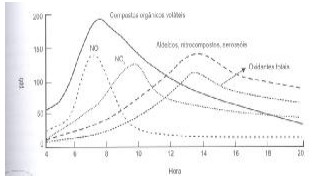
Figura 1 Variação da composição de gases atmosféricos relacionados com o smog fotoquímico ao longo do dia. (Fonte: Introdução à química ambiental. ROCHA, Julio Cesar; COSTA, André H.,CARDOSO; Arnaldo A. 2. ed. Porto Alegre: Bookman, 2009. p. 111).
Com relação à formação do smog fotoquímico,
é incorreto afirmar.
Marque a alternativa que apresenta corretamente a nomenclatura dos compostos citados, de acordo com a sequência mencionada no texto:
O composto mais comum de cálcio é o carbonato de cálcio, que ocorre naturalmente na forma de calcário. O calcário é decomposto por aquecimento em óxido de cálcio e dióxido de carbono. Por sua vez, o óxido de cálcio reage exotermicamente com a água, formando o hidróxido de cálcio, conhecido como cal apagado.
Assinale a alternativa que apresenta corretamente as fórmulas químicas dos compostos citados no texto: carbonato de cálcio, óxido de cálcio, dióxido de carbono e hidróxido de cálcio:
“Solução saturada: solução que contém a quantidade máxima de soluto em determinada quantidade de solvente, a determinada temperatura; a relação entre quantidades máximas de soluto e quantidade de solvente é denominada de coeficiente de solubilidade”.
“Solução insaturada: quando a solução contém uma quantidade de soluto inferior ao seu coeficiente de solubilidade, na temperatura em que se encontra a solução”.
“Solução supersaturada: quando a solução contém uma quantidade de soluto dissolvido superior ao seu coeficiente de solubilidade, na temperatura em que se ela se encontra. É instável” .
USBERCO, João e SALVADOR, Edgard, Físico-química, São Paulo, Ed Saraiva, 2009, Pág. 18
FONSECA, Martha Reis Marques da, Química Geral, São Paulo, Ed FTD, 2007, Pág. 18 e 19.
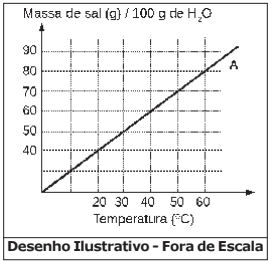
Considere o gráfico da curva de solubilidade em função da temperatura para um sal hipotético A. No gráfico, a linha contínua representa a solubilidade máxima do soluto (sal A) em 100 g de água na temperatura correspondente.
Acerca desse gráfico e processo de solubilidade são feitas as seguintes afirmativas:
I – Na temperatura de 20 ºC, misturando-se 50 g do sal A em 100 g de água, ter-se-á um sistema heterogêneo.
II – Na temperatura de 40 ºC, a adição de 50 g do sal A em 100 g de água produzirá uma solução insaturada.
III – 200 g de água dissolvem totalmente 90 g do sal A a 30 ºC.
IV – Uma solução contendo 60 g do sal A em 100 g de água será saturada em 60 ºC.
Das afirmativas feitas estão corretas apenas
(Fonte: <http://istoe.com.br>.)
A notícia acima menciona as reações de outros países após o presidente dos EUA anunciar que não respeitará o acordo firmado entre 195 países para reduzir emissões de gases de efeito estufa no contexto do desenvolvimento sustentável.
O objetivo do acordo é voltado à redução na emissão principalmente do gás:
I. NH4+ + NH2 – ➝ 2NH3 . II. CH3 NH2 + H2O ➝ CH3 NH3+ + OH– III. SO3 2– + S ➝ S2 O3 2–
As espécies que atuam como ácido nas reações representadas em I, II e III são, respectivamente,
Considere a curva de solubilidade da sacarose.
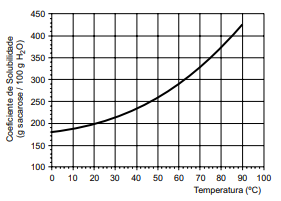
A temperatura em que se iniciou a cristalização e a massa máxima de açúcar cristalizada na solução em repouso a 20 ºC são, correta e respectivamente,
Completou-se o volume do balão com água destilada. Considerando que se empregou a técnica quantitativa na preparação da solução, a concentração de íons nitrato na solução preparada é
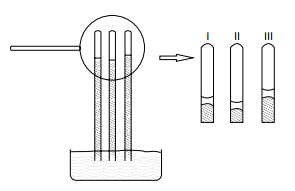
Nesse experimento, a água, a solução de cloreto de sódio e a solução de glicose estão contidas, respectivamente, nos tubos
Assinale a alternativa que completa, correta e respectivamente, as lacunas.
(Dados: Kf = 1,86 ºC.kg.mol-1 ; M(g.mol-1 ): Cl = 35,5; Na = 23)
A diferença na temperatura de fusão (em °C) na mistura obtida ao se dissolver 200 g de sal de cozinha em 1 kg de água, em relação à água pura, é de:
É requerido que fazendas produtoras de leite bovino controlem a acidez do leite que está aguardando o processamento. Essa acidez é resultante da conversão da lactose em ácido lático (ácido 2-hidroxipropanoico) por ação de microrganismos:
C12H22O11 + H2O → 4C3H6O3
Um fazendeiro decidiu fazer um experimento para determinar a taxa de geração de ácido lático no leite armazenado: retirou uma amostra de 50 cm3 de leite, cuja concentração de ácido lático é de 1,8 g/L, e, depois de três horas, utilizou 40 cm3 de uma solução 0,1 molar de NaOH para neutralizá-la.
Conclui-se que a taxa média de produção de ácido lático por litro de leite é:
I. A uma solução de nitrato de prata é adicionada uma solução de cloreto de sódio, com a formação de um precipitado. II. O precipitado obtido em (I) é filtrado e misturado a hidróxido de sódio sólido, com um pouco de água. A mistura é aquecida, produzindo um sólido marrom escuro. III. O sólido preparado em (II) é aquecido junto a uma solução concentrada de glicose, formando um sólido cinzento.
Assinale a alternativa que apresenta corretamente os sólidos produzidos em I, II e III, respectivamente.