Questões Militares
Sobre soluções e substâncias inorgânicas em química
Foram encontradas 284 questões
A Equação de Nernst, desenvolvida pelo químico e físico alemão Walther Hermann Nernst, é a relação quantitativa que permite calcular a força eletromotriz de uma pilha para concentrações de íons diferentes de uma unidade. Também é usada para cálculos em titulação de oxidação-redução.
A equação a 25°C pode ser escrita de forma reduzida como: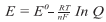
Sendo: R = 8,315 J K-1 mol-1; T = 298,2 K (25°C); F = 96485 C mol-1
Calcule a força eletromotriz para a seguinte pilha a 25°C: Fe / Fe2 + (0,02M) || Cu2
+(0,2M) / Cu
Dados: potencial padrão de redução (Eº Fe = -0,44V e Eº Cu = +0,40V).
A soda cáustica é o nome comercial dado ao composto hidróxido de sódio (NaOH). Este composto é largamente aplicado na indústria para a purificação de derivados de petróleo e de óleos vegetais. É também utilizado na fabricação de produtos de uso doméstico, como o sabão.
Dado: MM (NaOH) = 40,00g/mol, qual a concentração em quantidade de matéria de uma solução que foi
preparada dissolvendo-se 200,00g de hidróxido de sódio em água e completando-se para 2,00L de solução?
A afirmativa a seguir contextualiza a questão. Leia‐a atentamente.
“A corrosão é a deterioração de um material, geralmente metálico, por ação química ou eletroquímica do meio ambiente associada ou não a esforços mecânicos.”
(GENTIL, V. corrosão. LTC. 6ª ed. 2012.)
Nem sempre é possível, nem de interesse, ter as concentrações iônicas a 1M ou atividade unitária, por isso se utiliza certa equação para poder fazer o cálculo da determinação dos novos potenciais. Esta equação foi desenvolvida por qual cientista?CrCl3 + NaOH + H2O2 → Na2CrO4 + NaCl + H2O
CONSTANTES

DEFINIÇÕES


Considere as seguintes proposições para espécies químicas no estado gasoso:
I. A energia de ionização do íon Be3+ é maior do que a do íon He+ .
II. O momento dipolar elétrico total da molécula de XeF4 é maior do que o da molécula de XeF2.
III. A energia necessária para quebrar a molécula de F2 é maior do que a energia necessária para quebrar a molécula de O2.
IV. A energia do orbital 2s do átomo de berílio é igual à energia do orbital 2s do átomo de boro.
Das proposições acima, está(ão) CORRETA(S)
CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


CONSTANTES

DEFINIÇÕES


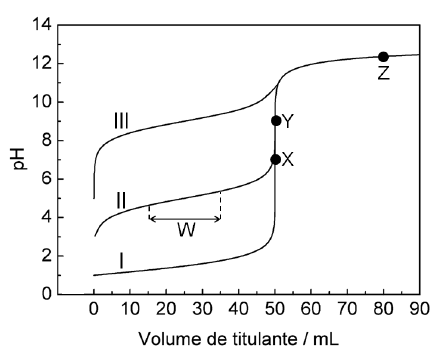
Na figura ao lado são respectivamente apresentadas as curvas de titulação de 50 mL de soluções aquosas 0,1 mol·L-1 dos ácidos I, II e III, tituladas com uma solução aquosa 0,1 mol·L-1 em NaOH. Baseado nas informações contidas na figura, assinale opção ERRADA.
CONSTANTES

DEFINIÇÕES


Um dos critérios para a classificação de um óxido é baseado nas suas propriedades ácido-base. Assim, os óxidos podem ser ácidos, básicos, anfóteros ou neutros. Sendo assim, considere os óxidos a seguir.
I- P4O10
II- K20
III- N2O
IV- Al2O 3
Assinale a opção que corretamente apresenta os tipos de
óxidos acima discriminados:
Assinale a opção que completa corretamente as lacunas da sentença abaixo.
"O ponto de ebulição de um líquido é a ,________________ , na qual a pressão de vapor do líquido é ________________ à pressão externa ou atmosférica”.
De acordo com o conceito de ácido-base de BronstedLowry, analise as equações abaixo.
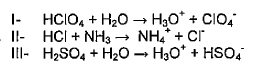
Com base nas equações acima, é INCORRETO afirmar
que
Analise a figura e a tabela a seguir.
